Современная классификация антибиотиков. Антибиотики. Основные классификации антибиотиков. Классификация по химическому строению. Механизм антимикробного действия антибиотиков Антибиотики и их классификация
Антибиотики – огромная группа бактерицидных препаратов, каждый из которой характеризуется своим спектром действия, показаниями к применению и наличием тех или иных последствий
Антибиотики – вещества, способные подавлять рост микроорганизмов или уничтожать их. Согласно определению ГОСТа, к антибиотикам относятся вещества растительного, животного или же микробного происхождения. В настоящее время это определение несколько устарело, так как создано огромное количество синтетических препаратов, однако прообразом для их создания послужили именно природные антибиотики.
История антимикробных препаратов начинается с 1928 года, когда А. Флемингом был впервые открыт пенициллин . Это вещество было именно открыто, а не создано, так как оно всегда существовало в природе. В живой природе его вырабатывают микроскопические грибы рода Penicillium, защищая себя от других микроорганизмов.
Менее чем за 100 лет создано более сотни различных антибактериальных препаратов. Некоторые из них уже устарели и не используются в лечении, а некоторые только вводятся в клиническую практику.

Как действуют антибиотики
Рекомендуем прочитать:
Все антибактериальные препараты по эффекту воздействия на микроорганизмы можно разделить на две большие группы:
- бактерицидные – непосредственно вызывают гибель микробов;
- бактериостатические – препятствуют размножению микроорганизмов. Не способные расти и размножаться, бактерии уничтожаются иммунной системой больного человека.
Свои эффекты антибиотики реализуют множеством способов: некоторые из них препятствуют синтезу нуклеиновых кислот микробов; другие препятствуют синтезу клеточной стенки бактерий, третьи нарушают синтез белков, а четвертые блокируют функции дыхательных ферментов.
Группы антибиотиков
Несмотря на многообразие этой группы препаратов, все их можно отнести к нескольким основным видам. В основе этой классификации лежит химическая структура – лекарства из одной группы имеют схожую химическую формулу, отличаясь друг от друга наличием или отсутствием определенных фрагментов молекул.
Классификация антибиотиков подразумевает наличие групп:
- Производные пенициллина . Сюда относятся все препараты, созданные на основе самого первого антибиотика. В этой группе выделяют следующие подгруппы или поколения пенициллиновых препаратов:
- Природный бензилпенициллин, который синтезируется грибами, и полусинтетические препараты: метициллин, нафциллин.
- Синтетические препараты: карбпенициллин и тикарциллин, обладающие более широким спектром воздействия.
- Мециллам и азлоциллин, имеющие еще более широкий спектр действия.
- Цефалоспорины – ближайшие родственники пенициллинов. Самый первый антибиотик этой группы – цефазолин С, вырабатывается грибами рода Cephalosporium. Препараты этой группы в большинстве своем обладают бактерицидным действием, то есть убивают микроорганизмы. Выделяют несколько поколений цефалоспоринов:
- I поколение: цефазолин, цефалексин, цефрадин и др.
- II поколение: цефсулодин, цефамандол, цефуроксим.
- III поколение: цефотаксим, цефтазидим, цефодизим.
- IV поколение: цефпиром.
- V поколение: цефтолозан, цефтопиброл.
Отличия между разными группами состоят в основном в их эффективности – более поздние поколения имеют больший спектр действия и более эффективны. Цефалоспорины 1 и 2 поколений в клинической практике сейчас используются крайне редко, большинство из них даже не производится.
- – препараты со сложной химической структурой, оказывающие бактериостатическое действие на широкий спектр микробов. Представители: азитромицин, ровамицин, джозамицин, лейкомицин и ряд других. Макролиды считаются одними из самых безопасных антибактериальных препаратов – их можно применять даже беременным. Азалиды и кетолиды – разновидности макорлидов, имеющие отличия в структуре активных молекул.
Еще одно достоинство этой группы препаратов – они способны проникать в клетки человеческого организма, что делает их эффективными при лечении внутриклеточных инфекций: , .

- Аминогликозиды . Представители: гентамицин, амикацин, канамицин. Эффективны в отношении большого числа аэробных грамотрицательных микроорганизмов. Эти препараты считаются наиболее токсичными, могут привести к достаточно серьезным осложнениям. Применяются для лечения инфекций мочеполового тракта, .
- Тетрациклины . В основном этой полусинтетические и синтетические препараты, к которым относятся: тетрациклин, доксициклин, миноциклин. Эффективны в отношении многих бактерий. Недостатком этих лекарственных средств является перекрестная устойчивость, то есть микроорганизмы, выработавшие устойчивость к одному препарату, будут малочувствительны и к другим из этой группы.
- Фторхинолоны . Это полностью синтетические препараты, которые не имеют своего природного аналога. Все препараты этой группы делятся на первое поколение (пефлоксацин, ципрофлоксацин, норфлоксацин) и второе (левофлоксацин, моксифлоксацин). Используются чаще всего для лечения инфекций ЛОР-органов ( , ) и дыхательных путей ( , ).
- Линкозамиды. К этой группе относятся природный антибиотик линкомицин и его производное клиндамицин. Оказывают и бактериостатическое, и бактерицидное действия, эффект зависит от концентрации.
- Карбапенемы . Это одни из самых современных антибиотиков, действующих на большое количество микроорганизмов. Препараты этой группы относятся к антибиотикам резерва, то есть применяются в самых сложных случаях, когда другие лекарства неэффективны. Представители: имипенем, меропенем, эртапенем.
- Полимиксины . Это узкоспециализированные препараты, используемые для лечения инфекций, вызванных . К полимиксинам относятся полимиксин М и В. Недостаток этих лекарств – токсическое воздействие на нервную систему и почки.
- Противотуберкулезные средства . Это отдельная группа препаратов, обладающих выраженным действием на . К ним относятся рифампицин, изониазид и ПАСК. Другие антибиотики тоже используют для лечения туберкулеза, но только в том случае, если к упомянутым препаратам выработалась устойчивость.
- Противогрибковые средства . В эту группы отнесены препараты, используемые для лечения микозов – грибковых поражений: амфотирецин В, нистатин, флюконазол.
Способы применения антибиотиков
Антибактериальные препараты выпускаются в разных формах: таблетках, порошке, из которого готовят раствор для инъекций, мазях, каплях, спрее, сиропе, свечах. Основные способы применения антибиотиков:
- Пероральный – прием через рот. Принять лекарство можно в виде таблетки, капсулы, сиропа или порошка. Кратность приема зависит от вида антибиотиков, к примеру, азитромицин принимают один раз в день, а тетрациклин – 4 раза в день. Для каждого вида антибиотика есть рекомендации, в которых указано, когда его нужно принимать – до еды, во время или после. От этого зависит эффективность лечения и выраженность побочных эффектов. Маленьким детям антибиотики назначают иногда в виде сиропа – детям проще выпить жидкость, чем проглотить таблетку или капсулу. К тому же, сироп может быть подслащен, чтобы избавиться от неприятного или горького вкуса самого лекарства.
- Инъекционный – в виде внутримышечных или внутривенных инъекций. При этом способе препарат быстрее попадает в очаг инфекции и активнее действует. Недостатком этого способа введения является болезненность при уколе. Применяют инъекции при среднетяжелом и тяжелом течении заболеваний.
Важно: делать уколы должна исключительно медицинская сестра в условиях поликлиники или стационара! На дому антибиотики колоть категорически не рекомендуется.
- Местный – нанесение мазей или кремов непосредственно на очаг инфекции. Этот способ доставки препарата в основном применяется при инфекциях кожи – рожистом воспалении, а также в офтальмологии – при инфекционном поражении глаза, например, тетрациклиновая мазь при конъюнктивите.
Путь введения определяет только врач. При этом учитывается множество факторов: всасываемость препарата в ЖКТ, состояние пищеварительной системы в целом (при некоторых заболеваниях скорость всасывания снижается, а эффективность лечения уменьшается). Некоторые препараты можно вводить только одним способом.
При инъекционном введении необходимо знать, чем можно растворить порошок. К примеру, Абактал можно разводить только глюкозой, так как при использовании натрия хлорида он разрушается, а значит, и лечение будет неэффективным.
Чувствительность к антибиотикам

Любой организм рано или поздно привыкает к самым суровым условиям. Справедливо это утверждение и по отношению к микроорганизмам – в ответ на длительное воздействие антибиотиков микробы вырабатывают устойчивость к ним. Во врачебную практику было введено понятие чувствительности к антибиотикам – с какой эффективностью воздействует тот или иной препарат на возбудителя.
Любое назначение антибиотиков должно опираться на знание о чувствительности возбудителя. В идеале, перед назначением препарата врач должен провести анализ на чувствительность, и назначить самый действенный препарат. Но время проведения такого анализа в самом лучшем случае – несколько дней, а за это время инфекция может привести к самому печальному результату.
Поэтому при инфекции с невыясненным возбудителем врачи назначают препараты эмпирическим путем – с учетом наиболее вероятного возбудителя, со знанием эпидемиологической обстановки в конкретном регионе и лечебном учреждении. Для этого используют антибиотики широкого спектра действия.
После выполнения анализа на чувствительность врач имеет возможность сменить препарат на более эффективный. Замена препарата может быть произведена и при отсутствии эффекта от лечения на 3-5 сутки.
Более эффективно этиотропное (целевое) назначение антибиотиков. При этом выясняется, чем вызвано заболевание – с помощью бактериологического исследования устанавливается вид возбудителя. Затем врач подбирает конкретный препарат, к которому у микроба отсутствует резистентность (устойчивость).
Всегда ли эффективны антибиотики
Антибиотики действуют только на бактерии и грибы! Бактериями считаются одноклеточные микроорганизмы. Насчитывается несколько тысяч видов бактерий, некоторые из которых вполне нормально сосуществуют с человеком – в толстом кишечнике обитает более 20 видов бактерий. Часть бактерий является условно-патогенными – они становятся причиной болезни только при определенных условиях, например, при попадании в нетипичное для них место обитания. Например, очень часто простатит вызывает кишечная палочка, попадающая восходящим путем в из прямой кишки.
Обратите внимание: абсолютно неэффективны антибиотики при вирусных заболеваниях. Вирусы во много раз меньше бактерий, и у антибиотиков попросту нет точки приложения своей способности. Поэтому же антибиотики при простуде не оказывают эффекта, так как простуда в 99% случаев вызвана вирусами.
Антибиотики при кашле и бронхите могут быть эффективны, если эти явления вызваны бактериями. Разобраться в том, чем вызвано заболевание может только врач – для этого он назначает анализы крови, при необходимости – исследование мокроты, если она отходит.
Важно: назначать самому себе антибиотики недопустимо! Это приведет лишь к тому, что часть возбудителей выработает резистентность, и в следующий раз болезнь будет вылечить гораздо сложнее.
Безусловно, эффективны антибиотики при – это заболевание имеет исключительно бактериальную природу, вызывают ее стрептококки или стафилококки. Для лечения ангины используют самые простые антибиотики – пенициллин, эритромицин. Самое важное в лечение ангины- это соблюдение кратности приема препаратов и продолжительность лечения – не менее 7 дней. Нельзя прекращать прием лекарства сразу после наступления состояния, что обычно отмечается на 3-4 день. Не следует путать истинную ангину с тонзиллитом, который может быть вирусного происхождения.
Обратите внимание: недолеченная ангина может стать причиной острой ревматической лихорадки или !
Воспаление легких () может иметь как бактериальное, так и вирусное происхождение. Бактерии вызывают пневмонию в 80% случаев, поэтому даже при эмпирическом назначении антибиотики при пневмонии оказывают хороший эффект. При вирусных же пневмониях антибиотики не обладают лечебным действием, хотя и препятствуют присоединению бактериальной флоры к воспалительному процессу.
Антибиотики и алкоголь
Одновременный прием алкоголя и антибиотиков за короткий промежуток времени ни к чему хорошему не приводит. Некоторые препараты разрушаются в печени, как и алкоголь. Наличие в крови антибиотика и алкоголя дает сильную нагрузку на печень – она попросту не успевает обезвредить этиловый спирт. В результате этого повышается вероятность развития неприятных симптомов: тошноты, рвоты, кишечных расстройств.
Важно: ряд препаратов взаимодействует с алкоголем на химическом уровне, в результате чего напрямую снижается лечебное действие. К таким препаратам относятся метронидазол, левомицетин, цефоперазон и ряд других. Одновременный прием алкоголя и этих препаратов может не только снизить лечебный эффект, но и привести к одышке, судорогам и смерти.
Конечно, некоторые антибиотики можно принимать на фоне употребления алкоголя, но зачем рисковать здоровьем? Лучше ненадолго воздержаться от спиртных напитков – курс антибактериальной терапии редко превышает 1,5-2 недели.
Антибиотики при беременности
 Беременные женщины болеют инфекционными болезнями ничуть ни реже, чем все остальные. А вот лечение беременных антибиотиками весьма затруднительно. В организме беременной растет и развивается плод – будущий ребенок, весьма чувствительный ко многим химическим веществами. Попадание в формирующийся организм антибиотиков может спровоцировать развитие пороков развития плода, токсическое повреждение центральной нервной системе плода.
Беременные женщины болеют инфекционными болезнями ничуть ни реже, чем все остальные. А вот лечение беременных антибиотиками весьма затруднительно. В организме беременной растет и развивается плод – будущий ребенок, весьма чувствительный ко многим химическим веществами. Попадание в формирующийся организм антибиотиков может спровоцировать развитие пороков развития плода, токсическое повреждение центральной нервной системе плода.
В первый триместр желательно избегать применения антибиотиков вообще. Во второй и третий триместры их назначение более безопасно, но тоже, по возможности, должно быть ограничено.
Отказаться от назначения антибиотиков беременной женщине нельзя при следующих болезнях:
- Пневмония;
- ангина;
- инфицированные раны;
- специфические инфекции: бруцеллез, бореллиоз;
- половые инфекции: , .
Какие же антибиотики можно назначить беременной?
Не оказывают почти никакого влияния на плод пенициллин, препараты цефалоспоринового ряда, эритромицин, джозамицин. Пенициллин, хотя и проходит через плаценту, не оказывает негативного воздействия на плод. Цефалоспорин и другие названные препараты проникают через плаценту в крайне низкой концентрации и не способны навредить будущему ребенку.
К условно безопасным препаратам относят метронидазол, гентамицин и азитромицин. Их назначают только по жизненным показаниям, когда польза для женщины перевешивает риск для ребенка. К таким ситуациям относят тяжелые пневмонии, сепсис, другие тяжелые инфекции, при которых без антибиотиков женщина может попросту погибнуть.
Какие из препаратов нельзя назначать при беременности
Нельзя применять у беременных следующие препараты:
- аминогликозиды – способны привести к врожденной глухоте (исключение - гентамицин);
- кларитромицин, рокситромицин – в экспериментах оказывали токсичное действие на зародыши животных;
- фторхинолоны ;
- тетрациклин – нарушает формирование костной системы и зубов;
- левомицетин – опасен на поздних сроках беременности за счет угнетения функций костного мозга у ребенка.
По некоторым антибактериальным препаратам нет данных о негативном воздействии на плод. Объясняется это просто – на беременных женщинах не проводят экспериментов, позволяющих выяснить токсичность препаратов. Эксперименты же на животных не позволяют со 100% уверенностью исключить все негативные эффекты, так как метаболизм препаратов у человека и животных может значительно отличаться.
Следует учесть, что перед следует также отказаться от приема антибиотиков или изменить планы по зачатию. Некоторые препараты обладают кумулятивным эффектом – способны накапливаться в организме женщины, и еще некоторое время после окончания курса лечения постепенно метаболизируются и выводятся. Беременеть рекомендуется не ранее чем через 2-3 недели после окончания приема антибиотиков.
Последствия приема антибиотиков
Попадание антибиотиков в организм человека ведет не только к уничтожению болезнетворных бактерий. Как и все инородные химические препараты, антибиотики оказывают системное действие – в той или иной мере воздействуют на все системы организма.
Можно выделить несколько групп побочных эффектов антибиотиков:
Аллергические реакции
Практически любой антибиотик может стать причиной аллергии. Выраженность реакции бывает разной: сыпь на теле, отек Квинке (ангионевротический отек), анафилактический шок. Если аллергическая сыпь практически не опасна, то анафилактический шок может привести к смертельному исходу. Риск шока гораздо выше при уколах антибиотиков, именно поэтому инъекции должны делаться только в медицинских учреждениях – там может быть оказана неотложная помощь.
Антибиотики и другие антимикробные ЛС, вызывающие перекрестные аллергические реакции:
Токсические реакции
Антибиотики могут повреждать многие органы, но больше всего подвержена их воздействию печень – на фоне антибактериальной терапии может возникнуть токсический гепатит. Отдельные препараты оказывают избирательное токсическое воздействие на другие органы: аминогликозиды – на слуховой аппарат (вызывают глухоту); тетрациклины угнетают рост костной ткани у детей.
Обратите внимание : токсичность препарата обычно зависит от его дозы, но при индивидуальной непереносимости иногда достаточно и меньших доз, чтобы проявился эффект.
Воздействие на желудочно-кишечный тракт
При приеме некоторых антибиотиков пациенты часто жалуются на боли в желудке, тошноту, рвоту, расстройства стула (диарея). Обусловлены эти реакции чаще всего местнораздражающим действием препаратов. Специфическое воздействие антибиотиков на флору кишечника ведет к функциональным расстройствам его деятельности, что сопровождается чаще всего диареей. Состояние это так и называется – антибиотикассоциированной диареей, которая в народе больше известна под термином дисбактериоз после антибиотиков.
Другие побочные эффекты
К прочим побочным последствиям относят:
- угнетение иммунитета;
- появление антибиотикорезистентных штаммов микроорганизмов;
- суперинфекция – состояние, при котором активизируются устойчивые к данному антибиотику микробы, приводя к возникновению нового заболевания;
- нарушение обмена витаминов – обусловлено угнетением естественной флоры толстой кишки, которая синтезирует некоторые витамины группы В;
- бактериолиз Яриша-Герксгеймера – реакция.ю возникающая при применении бактерицидных препаратов, когда в результате одномоментной гибели большого числа бактерий в кровь выбрасывается большое количество токсинов. Реакция схожа по клинике с шоком.
Можно ли использовать антибиотики с профилактической целью
Самообразование в сфере лечения привела к тому, что многие пациенты, особенно это касается молодых мам, стараются назначить самому себе (или своему ребенку) антибиотик при малейших признаках простуды. Антибиотики не обладают профилактическим действием – они лечат причину заболевания, то есть устраняют микроорганизмы, а при отсутствии проявляются лишь побочные эффекты препаратов.
Существует ограниченное количество ситуаций, когда антибиотики вводят до клинических проявлений инфекции, с целью ее предупредить:
- хирургическая операция – в этом случае антибиотик, находящийся в крови и тканях, препятствует развитию инфекции. Как правило, достаточно однократной дозы препарата, введенной за 30-40 минут до вмешательства. Иногда даже после аппендэктомии в послеоперационном периоде не колют антибиотики. После «чистых» хирургических операций антибиотики вообще не назначают.
- крупные травмы или раны (открытые переломы, загрязнение раны землей). В этом случае абсолютно очевидно, что в рану попала инфекция и следует «задавить» ее до того, как она проявится;
- экстренная профилактика сифилиса проводится при незащищенном сексуальном контакте с потенциально больным человеком, а также у медработников, которым кровь инфицированного человека или другая биологическая жидкость попала на слизистую оболочку;
- пенициллин может быть назначен детям для профилактики ревматической лихорадки, являющейся осложнением ангины.
Антибиотики для детей
 Применение антибиотиков у детей в целом не отличается от применения их у других групп людей. Детям маленького возраста педиатры чаще всего назначают антибиотики в сиропе. Эта лекарственная форма удобнее для приема, в отличие от уколов совершенно безболезненная. Детям более старшего возраста могут назначаться антибиотики в таблетках и капсулах. При тяжелом течении инфекции переходят на парентеральный путь введения – уколы.
Применение антибиотиков у детей в целом не отличается от применения их у других групп людей. Детям маленького возраста педиатры чаще всего назначают антибиотики в сиропе. Эта лекарственная форма удобнее для приема, в отличие от уколов совершенно безболезненная. Детям более старшего возраста могут назначаться антибиотики в таблетках и капсулах. При тяжелом течении инфекции переходят на парентеральный путь введения – уколы.
Важно : главная особенность в использовании антибиотиков в педиатрии заключается в дозировках – детям назначают меньшие дозы, так как расчет препарата ведется в пересчете на килограмм массы тела.
Антибиотики – это очень эффективные препараты, имеющие в то же время большое количество побочных эффектов. Чтобы вылечиться с их помощью и не нанести вреда своему организму, принимать их следует только по назначению врача.
Какие бывают антибиотики? В каких случаях прием антибиотиков необходим, а в каких опасен? Главные правила лечения антибиотиками рассказывает педиатр, доктор Комаровский:
Гудков Роман, врач-реаниматолог
Антибиотики - это группа лекарственных средств, которые способны угнетать рост и развитие живых клеток. Наиболее часто их используют для лечения инфекционных процессов, вызванных различными штаммами бактерий. Первый препарат был обнаружен в 1928 году британским бактериологом Александром Флемингом. Однако, некоторые антибиотики также назначают при онкологических патологиях, как компонент комбинированной химиотерапии. На вирусы эта группа лекарственных средств практически не действует, за исключением некоторых тетрациклинов. В современной фармакологии термин «антибиотики» все чаще заменяется «антибактериальными препаратами».
Первыми синтезировали лекарственные средства из группы пенициллинов. Они помогли существенно снизить летальность таких заболеваний, как пневмония, сепсис, менингит, гангрена и сифилис. Со временем из-за активного использования антибиотиков у многих микроорганизмов начала возникать стойкость к ним. Поэтому важной задачей стал поиск новых групп антибактериальных препаратов.
Постепенно фармацевтические компании синтезировали и начали выпускать цефалоспорины, макролиды, фторхинолоны, тетрациклины, левомицетин, нитрофураны, аминогликозиды, карбапенемы и другие антибиотики.
Антибиотики и их классификация
Основной фармакологической классификации антибактериальных препаратов является разделение за действием на микроорганизмы. За этой характеристикой различают две группы антибиотиков:
- бактерицидные - лекарственные средства вызывают гибель и лизис микроорганизмов. Это действие обусловлено способностью антибиотиков ингибировать синтез мембран или подавлять продукцию компонентов ДНК. Данным свойством владеют пенициллины, цефалоспорины, фторхинолоны, карбапенемы, монобактамы, гликопептиды и фосфомицин.
- бактериостатические - антибиотики способны угнетать синтез белков микробными клетками, что делает невозможным их размножение. Как результат, ограничивается дальнейшее развитие патологического процесса. Это действие характерно для тетрациклинов, макролидов, аминогликозидов, линкозаминов и аминогликозидов.
За спектром действия различают также две группы антибиотиков:
- с широким - препарат можно использовать для лечения патологий, вызванных большим числом микроорганизмов;
- с узким - медикамент влияет на отдельные штаммы и виды бактерий.
Еще существует классификация антибактериальных препаратов по их происхождению:
- природные - получают из живых организмов;
- полусинтетические антибиотики являются модифицированными молекулами природных аналогов;
- синтетические - их производят полностью искусственно в специализированных лабораториях.
Описание различных групп антибиотиков
Бета-лактамы
Пенициллины
Исторически первая группа антибактериальных препаратов. Имеет бактерицидный эффект на широкий спектр микроорганизмов. Пенициллины различают следующих групп:
- природные пенициллины (синтезируются в нормальных условиях грибами) - бензилпенициллин, феноксиметилпенициллин;
- полусинтетические пенициллины, которые имеют большую стойкость против пенициллиназ, что значительно расширяет их спектр действия - медикаменты оксациллина, метициллина;
- с расширенным действием - препараты амоксициллина, ампициллина;
- пенициллины с широким действием на микроорганизмы - медикаменты мезлоциллина, азлоциллина.
 Чтобы уменьшить резистентность бактерий и увеличить шанс успеха антибиотикотерапии, к пенициллинам активно добавляют ингибиторы пенициллиназ - клавулановую кислоту, тазобактам и сульбактам. Так появились препараты «Аугментин», «Тазоцим», «Тазробида» и другие.
Чтобы уменьшить резистентность бактерий и увеличить шанс успеха антибиотикотерапии, к пенициллинам активно добавляют ингибиторы пенициллиназ - клавулановую кислоту, тазобактам и сульбактам. Так появились препараты «Аугментин», «Тазоцим», «Тазробида» и другие.
Применяют данные медикаменты при инфекциях дыхательной (бронхите, синусите, пневмониях, фарингите, ларингите), мочеполовой (цистите, уретрите, простатите, гонорее), пищеварительной (холецистите, дизентерии) систем, сифилисе и поражениях кожи. Из побочных эффектов наиболее часто встречаются аллергические реакции (крапивница, анафилактический шок, ангионевротический отек).
Пенициллины также являются наиболее безопасными средствами для беременных и младенцев.
Цефалоспорины
Эта группа антибиотиков владеет бактерицидным действием на большое количество микроорганизмов. Сегодня выделяют следующие поколения цефалоспоринов:

Подавляющее большинство данных медикаментов существует только в инъекционной форме, поэтому их используют преимущественно в клиниках. Цефалоспорины являются наиболее популярными антибактериальными средствами для использования в стационарах.
Данные препараты применяют для лечения огромного количества заболеваний: пневмоний, менингитов, генерализации инфекций, пиелонефритов, циститов, воспаления костей, мягких тканей, лимфангитов и других патологий. При использовании цефалоспоринов часто встречается гиперчувствительность. Иногда наблюдаются транзиторное снижение клиренса креатинина, боли в мышцах, кашель, повышение кровоточивости (из-за уменьшения витамина К).
Карбапенемы
Являются довольно новой группой антибиотиков. Как и остальные бета-лактамы, карбапенемы имеют бактерицидный эффект. К данной группе медикаментов остаются чувствительны огромное количество различных штаммов бактерий. Также карбапенемы проявляют стойкость против ферментов, которые синтезируют микроорганизмы. Данные  свойства привели к тому, что их считают препаратами спасения, когда остальные антибактериальные средства остаются неэффективными. Однако, их использование строго ограничено из-за опасений развития стойкости бактерий. К этой группе препаратов относятся меропенем, дорипенем, эртапенем, имипенем.
свойства привели к тому, что их считают препаратами спасения, когда остальные антибактериальные средства остаются неэффективными. Однако, их использование строго ограничено из-за опасений развития стойкости бактерий. К этой группе препаратов относятся меропенем, дорипенем, эртапенем, имипенем.
Используют карбапенемы для лечения сепсиса, пневмонии, перитонита, острых хирургических патологий брюшной полости, менингита, эндометрита. Также назначают данные препараты пациентам с иммунодефицитами или на фоне нейтропении.
Среди побочных эффектов нужно отметить диспепсические расстройства, головную боль, тромбофлебит, псевдомембранозный колит, судороги и гипокалиемию.
Монобактамы
 Монобактамы действуют преимущественно только на грамотрицательную флору. В клинике используется только одно действующее вещество из данной группы - азтреонам. С его преимуществ выделяется устойчивость к большинству бактериальных энзимов, что делает его препаратом выбора при неэффективности лечения пенициллинами, цефалоспоринами и аминогликозидами. В клинических рекомендациях азтреонам рекомендуется при энтеробактерной инфекции. Он применяется только внутривенно или внутримышечно.
Монобактамы действуют преимущественно только на грамотрицательную флору. В клинике используется только одно действующее вещество из данной группы - азтреонам. С его преимуществ выделяется устойчивость к большинству бактериальных энзимов, что делает его препаратом выбора при неэффективности лечения пенициллинами, цефалоспоринами и аминогликозидами. В клинических рекомендациях азтреонам рекомендуется при энтеробактерной инфекции. Он применяется только внутривенно или внутримышечно.
Среди показаний к приему нужно выделить сепсис, внебольничную пневмонию, перитонит, инфекции органов таза, кожи и опорно-двигательного аппарата. Применение азтреонама иногда приводит к развитию диспепсических симптомов, желтухи, токсического гепатита, головной боли, головокружения и аллергической сыпи.
Макролиды
Медикаменты также отмечаются низкой токсичностью, что позволяет их применять при беременности и в раннем возрасте ребенка. Их делят на следующие группы:
- природные, которые синтезировали в 50-60-х годах прошлого столетия - препараты эритромицина, спирамицина, джозамицина, мидекамицина;
- пролекарства (преобразуются в активную форму после метаболизма) - тролеандомицин;
- полусинтетические - медикаменты азитромицина, кларитромицина, диритромицина, телитромицина.
Макролиды применяют при многих бактериальных патологиях: язвенной болезни, бронхите, пневмонии, инфекциях ЛОР-органов, дерматозе, болезни Лайма, уретрите, цервиците, роже, импентиго. Нельзя использовать эту группу медикаментов при аритмиях, недостаточности почечной функции.
Тетрациклины
 Впервые синтезировали тетрациклины более полувека тому. Данная группа владеет бактериостатическим эффектом против многих штаммов микробной флоры. В высоких концентрациях они проявляют и бактерицидное действие. Особенностью тетрациклинов является их способность накапливаться в костной ткани и эмали зубов.
Впервые синтезировали тетрациклины более полувека тому. Данная группа владеет бактериостатическим эффектом против многих штаммов микробной флоры. В высоких концентрациях они проявляют и бактерицидное действие. Особенностью тетрациклинов является их способность накапливаться в костной ткани и эмали зубов.
С одной стороны это позволяет клиницистам активно использовать их при хроническом остеомиелите, а с другой нарушает развитие скелета у детей. Поэтому их категорически нельзя применять при беременности, лактации и в возрасте до 12 лет. К тетрациклинам, кроме одноименного препарата, относят доксициклин, окситетрациклин, миноциклин и тигециклин.
Используют их при различных кишечных патологиях, бруцеллезе, лептоспирозе, туляремии, актиномикозе, трахоме, болезни Лайма, гонококковой инфекции и риккетсиозах. Среди противопоказаний выделяют также порфирию, хронические заболевания печени и индивидуальную непереносимость.
Фторхинолоны
Фторхинолоны являются большой группой антибактериальных средств с широким бактерицидным действием на патогенную микрофлору. Все препараты являются походными налидиксовой кислоты. Активное использование фторхинолонов началось с 70-х годов прошлого столетия. Сегодня их классифицируют по поколениям:
- I - препараты налидиксовой и оксолиновой кислоты;
- II - медикаменты с офлоксацином, ципрофлоксацином, норфлоксацином, пефлоксацином;
- III - препараты левофлоксацина;
- IV - медикаменты с гатифлоксацином, моксифлоксацином, гемифлоксацином.
 Последние поколения фторхинолонов получили название «респираторных», что обусловлено их активностью против микрофлоры, которая наиболее часто стает причиной развития пневмонии. Также они используются для лечения синуситов, бронхитов, кишечных инфекций, простатита, гонореи, сепсиса, туберкулеза и менингита.
Последние поколения фторхинолонов получили название «респираторных», что обусловлено их активностью против микрофлоры, которая наиболее часто стает причиной развития пневмонии. Также они используются для лечения синуситов, бронхитов, кишечных инфекций, простатита, гонореи, сепсиса, туберкулеза и менингита.
Среди недостатков необходимо выделить то, что фторхинолоны способны влиять на формирования опорно-двигательного аппарата, поэтому в детском возрасте, при беременности и в период лактации их можно назначать только по жизненным показаниям. Первое поколения препаратов также отличается высокой гепато- и нефротоксичностью.
Аминогликозиды
Аминогликозиды нашли активное применение в лечении бактериальной инфекции, вызванной грамотрицательной флорой. Они оказывают бактерицидное действие. Их высокая эффективность, которая не зависит от функциональной активности иммунитета пациента, сделала их незаменимыми средствами при его нарушениях и нейтропении. Различают следующие поколения аминогликозидов:

Назначают аминогликозиды при инфекциях дыхательной системы, сепсисе, инфекционном эндокардите, перитоните, менингите, цистите, пиелонефрите, остеомиелите и других патологиях. Среди побочных эффектов большое значение имеют токсическое воздействие на почки и снижение слуха.
Поэтому во время курса терапии необходимо регулярно проводить биохимический анализ крови (креатинин, ШКФ, мочевина) и аудиометрию. Беременным, в период лактации, больным с хронической болезнью почек или на гемодиализе аминогликозиды назначаются только по жизненным показаниям.
Гликопептиды
 Гликопептидные антибиотики владеют бактерицидным эффектом широкого спектра действия. Наиболее известны из них - блеомицин и ванкомицин. В клинической практике гликопептиды являются препаратами резерва, которые назначаются при неэффективности остальных антибактериальных средств или специфической чувствительности к ним возбудителя инфекции.
Гликопептидные антибиотики владеют бактерицидным эффектом широкого спектра действия. Наиболее известны из них - блеомицин и ванкомицин. В клинической практике гликопептиды являются препаратами резерва, которые назначаются при неэффективности остальных антибактериальных средств или специфической чувствительности к ним возбудителя инфекции.
Их часто комбинируют с аминогликозидами, что позволяет увеличить совокупное действие в отношении золотистого стафилококка, энтерококка и стрептококка. На микобактерии и грибы гликопептидные антибиотики не действуют.
Назначают данную группу антибактериальных средств при эндокардите, сепсисе, остеомиелите, флегмоне, пневмонии (в том числе осложненной), абсцессе и псевдомембранозном колите. Нельзя применять гликопептидные антибиотики при почечной недостаточности, повышенной чувствительности к препаратам, лактации, неврите слухового нерва, беременности и в период лактации.
Линкозамиды
 К линкозамидам относят линкомицин и клиндамицин. Эти препарат проявляют бактериостатическое действие на грамположительные бактерии. Их использую преимущественно в комбинации с аминогликозидами, как средства второй линии, для тяжелых пациентов.
К линкозамидам относят линкомицин и клиндамицин. Эти препарат проявляют бактериостатическое действие на грамположительные бактерии. Их использую преимущественно в комбинации с аминогликозидами, как средства второй линии, для тяжелых пациентов.
Линкозамиды назначают при аспирационной пневмонии, остеомиелите, диабетической стопе, некротическом фасциите и других патологиях.
Довольно часто во время их приема развивается кандидозная инфекция, головная боль, аллергические реакции и угнетение кроветворения.
Антибиотики широкого спектра сегодня являются наиболее востребованными лекарственными препаратами. Такую популярность они заслужили благодаря собственной универсальности и способности бороться сразу с несколькими раздражителями, оказывающих негативное влияние на здоровье человека.
Медики не рекомендуют применять подобные средства без предварительных клинических исследований и без рекомендаций врачей. Ненормированное использование антибиотиков может усугубить ситуацию и стать причиной возникновения новых заболеваний, а также оказать негативное влияние на иммунитет человека.
Антибиотики нового поколения
Риск применения антибиотиков благодаря современным медицинским разработкам практически сведен к нулю. Новые антибиотики имеют усовершенствованную формулу и принцип действия, благодаря чему их активные компоненты затрагивают исключительно на клеточном уровне патогенного агента, не нарушая полезной микрофлоры организма человека. И если раньше такие средства использовались в борьбе с ограниченным количеством патогенных агентов, сегодня они будут эффективны сразу против целой группы возбудителей.
Антибиотики делятся на следующие группы:
- тетрациклиновая группа - Тетрациклин;
- группа аминогликозидов - Стрептомицин;
- амфениколы антибиотики - Хлорамфеникол;
- пенициллиновый ряд препаратов - Амоксициллин, Ампициллин, Билмицин или же Тикарциклин;
- антибиотики группы карбапенемов - Имипенем, Меропенем или Эртапенем.
Вид антибиотика определяется врачом после тщательного исследования заболевания и исследования всех его причин. Лечения препаратом по назначению врача проходит эффективно и без осложнений.
Важно: Даже если ранее употребление того или иного антибиотика вам помогло, это еще не значит, что при возникновении похожих или полностью идентичных симптомов следует принимать тот же препарат.
Лучшие антибиотики широкого применения нового поколения
Тетрациклин
Обладает наиболее широким спектром применения;
Тетрациклин от чего помогает:
при бронхите, тонзиллите, фарингите, простатите, экземе и различных инфекциях ЖКТ и мягких тканей.
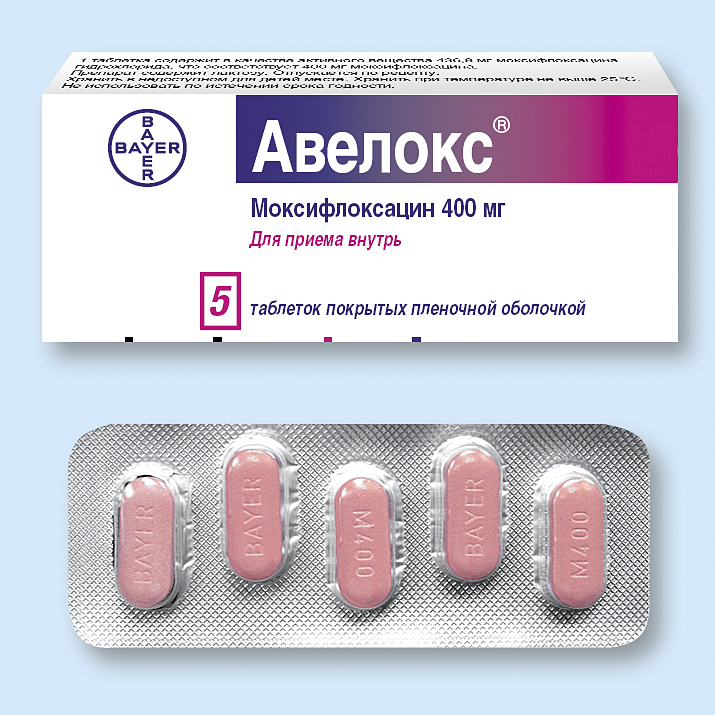
Наиболее эффективный антибиотик при хронических и острых заболеваниях;
Страна производитель – Германия (компания Bayer);
Препарат обладает очень широким спектром применения и включен Минздравом РФ в список необходимых лекарственных средств;
Практически не имеет побочных эффектов.
Амоксициллин

Наиболее безвредный и универсальный препарат;
Применяется как при заболеваниях с характерным повышением температуры, так и при прочих заболеваниях;
Наиболее эффективен при:
- инфекции дыхательных путей и ЛОР-органов (в том числе гайморит, бронхит, ангина, отит);
- инфекции ЖКТ;
- инфекции кожи и мягких тканей;
- инфекции мочеполовой системы;
- болезнь Лайма;
- дизентерия;
- менингит;
- сальмонеллез;
- сепсис.

Страна производитель – Великобритания;
От чего помогает?
бронхита, тонзиллита, гайморита, а также различных инфекций дыхательных путей.
Амоксиклав

Эффективный препарат с очень широким спектром применения, практически безвреден;
Основные преимущества:
- минимум противопоказаний и побочных действий;
- приятный вкус;
- быстродействие;
- не содержит красителей.

Быстродействующий препарат с очень широким спектром применеия;
Наиболее эффективен при борьбе с инфекциями, поражающими дыхательные пути, такими как: ангина, синусит, бронхит, пневмония. Также применяется при борьбе с инфекционными заболеваниями кожи и мягких тканей, мочеполовой, а также при кишечных заболеваниях.

Высокоактивен в отношении грамотрицательных микроорганизмов;
Страна производитель – Россия;
Наиболее эффективен при борьбе с грамположительными и грамотрицательными бактериями, микоплазмами, легионеллами, сальмонеллами, а также возбудителями, передающимися половым путем.
Авиказ

Быстродействующий препарат, практически не имеющий побочных эффектов;
Страна производитель – США;
Наиболее эффективен при лечении заболеваний мочевыводящих путей и почек.

Аппарат распространяется в ампулах (уколы), один из наиболее быстродействующих антибиотиков;
Наиболее эффективный препарат при лечении:
- пиелонефритах и инф. мочевыводящих путей;
- инфек. заболеваниях малого таза, эндометритах, послеоперационных инф-ях и септических абортах;
- бактериальных поражениях кожи и мягких тканей, включая диабетическую стопу;
- пневмониях;
- септицемиях;
- абдоминальных инфекций.
Дорипрекс

Синтетический противомикробный препарат с бактерицидной активностью;
Страна производитель – Япония;
Данный препарат является наиболее эффективным при лечении:
- внутрибольничных пневмоний;
- тяжёлых интраабдоминальных инфекций;
- осложнённых инф. мочевыделительной системы;
- пиелонефритах, с осложнённым течением и бактериемией.
Классификация антибиотиков по спектру действия и целям применения
Современная классификация антибиотиков по группам: таблица
| Основная группа | Подклассы |
| Бета-лактамы | |
| 1. Пенициллины | Природные; Антистафилококковые; Антисинегнойные; С расширенным спектром действ.; Ингибиторозащищённые; Комбинированные. |
| 2. Цефалоспорины | 4-ре поколения; Анти-MRSA цефемы. |
| 3. Карбапенемы | - |
| 4. Монобактамы | - |
| Аминогликозиды | Три поколения. |
| Макролиды | Четырнадцати-членные; Пятнадцати-членные (азолы); Шестнадцати-членные. |
| Сульфаниламиды | Короткого действ.; Средней длительности действ.; Длительного действ.; Сверхдлительные; Местные. |
| Хинолоны | Нефторированные (1-е поколение); Второе; Респираторные (3-е); Четвёртое. |
| Противотуберкулёзные | Основной ряд; Группа резерва. |
| Тетрациклины | Природные; Полусинтетические. |
Далее представлены виды антибиотиков этого ряда и их классификация в таблице.
| Группа | По действующему веществу выделяют препар.: | Названия |
| Природные | Бензилпенициллина | Бензилпенициллина Na и K соли. |
| Феноксиметилпенициллина | Метилпенициллин | |
| С пролонгированным дейст. | ||
| Бензилпенициллина прокаин | Бензилпенициллина новокаиновая соль. | |
| Бензилпенициллина/ Бензилпенициллина прокаин/ Бензатин бензилпенициллин | Бензициллин-3. Бициллин-3 | |
| Бензилпенициллина прокаин/Бензатин бензилпенициллин | Бензициллин-5. Бициллин-5 | |
| Антистафилококковые | Оксациллина | Оксациллин АКОС, натриевая соль Оксациллина. |
| Пенициллиназорезистентные | Клоксапциллин; Алюклоксациллин. |
|
| Обладающие расширенным спектром | Ампициллина | Ампициллин |
| Амоксициллина | Флемоксин солютаб, Оспамокс, Амоксициллин. | |
| С антисинегнойной активностью | Карбенициллина | Динатриевая соль карбенициллина, Карфециллин, Кариндациллин. |
| Уриедопенициллины | ||
| Пиперациллина | Пициллин, Пипрацил | |
| Азлоциллина | Натриевая соль азлоциллина, Секуропен, Мезлоциллин.. | |
| Ингибиторозащищённые | Амоксициллина/клавуланат | Ко-амоксиклав, Аугментин, Амоксиклав, Ранклав, Энханцин, Панклав. |
| Амоксициллина сульбактам | Трифамокс ИБЛ,. | |
| Амлициллина/сульбактам | Сулациллин,Уназин, Амписид. | |
| Пиперациллина/тазобактам | Тазоцин | |
| Тикарциллина/клавуланат | Тиментин | |
| Комбинация пенициллинов | Ампициллина/оксациллин | Ампиокс. |
Антибиотики по времени действия:
Группы антибиотиков и названия основных препаратов поколения.
| Поколения | Препар.: | Название |
| 1-е | Цефазолина | Кефзол. |
| Цефалексина* | Цефалексин-АКОС. | |
| Цефадроксила* | Дуроцеф. | |
| 2-е | Цефуроксима | Зинацеф, Цефурус. |
| Цефокситина | Мефоксин. | |
| Цефотетана | Цефотетан. | |
| Цефаклора* | Цеклор, Верцеф. | |
| Цефуроксим-аксетила* | Зиннат. | |
| 3-е | Цефотаксима | Цефотаксим. |
| Цефтриаксона | Рофецин. | |
| Цефоперазона | Медоцеф. | |
| Цефтазидима | Фортум, Цефтазидим. | |
| Цефоперазона/сульбак-тама | Сульперазон, Сульзонцеф, Бакперазон. | |
| Цефдиторена* | Спектрацеф. | |
| Цефиксима* | Супракс, Сорцеф. | |
| Цефподоксима* | Проксетил. | |
| Цефтибутена* | Цедекс. | |
| 4-е | Цефепима | Максипим. |
| Цефпирома | Кейтен. | |
| 5-е | Цефтобипрола | Зефтера. |
| Цефтаролина | Зинфоро. |
Под понятием инфекционных заболеваний подразумевают реакцию организма на присутствие патогенных микроорганизмов или инвазию ими органов и тканей, проявляющуюся воспалительным ответом. Для лечения применяются антимикробные препараты, избирательно действующие на эти микробы, с целью их эрадикации.
Микроорганизмы, приводящие к инфекционно-воспалительным заболеваниям в организме человека, подразделяются на:
- бактерии (истинные бактерии, риккетсии и хламидии, микоплазмы);
- грибы;
- вирусы;
- простейшие.
Поэтому, противомикробные средства разделяют на:
- антибактериальные;
- противовирусные;
- противогрибковые;
- противопротозойные.
Важно помнить, что один препарат может обладать несколькими видами активности.
Например, Нитроксолин ® , преп. с выраженным антибактериальным и умеренным противогрибковым эффектом — называют антибиотиком. Разница между таким средством и «чистым» противогрибковым в том, что Нитроксолин ® имеет ограниченную активность по отношению к некоторым видам Candida, зато обладает выраженным эффектом в отношении бактерий, на которые противогрибковое средство не подействует вообще.
В 50-х годах двадцатого столетия Флеминг, Чейн и Флори получили Нобелевскую премию в области медицины и физиологии за открытие пенициллина. Это событие, стало настоящей революцией в фармакологии, полностью перевернув базовые подходы к лечению инфекций и существенно увеличив шансы пациента на полное и быстрое выздоровление.
С появлением антибактериальных препаратов, многие заболевания вызывавшие эпидемии, опустошавшие ранее целые страны (чума, тиф, холера), превратились из «смертного приговора» в «болезнь, эффективно поддающуюся лечению» и в настоящее время, практически, не встречаются.
Антибиотики- это вещества биологического или искусственного происхождения, способные избирательно угнетать жизнедеятельность микроорганизмов.
То есть, отличительной особенностью их действия является то, что они влияют только на прокариотическую клетку, не повреждая клетки организма. Это связано с тем, что в тканях человека нет мишени-рецептора для их действия.
Антибактериальные ср-ва назначают при инфекционно-воспалительных заболеваниях, обусловленных бактериальной этиологией возбудителя или при тяжёлых вирусных инфекциях, с целью подавления вторичной флоры.
При выборе адекватной противомикробной терапии, необходимо учитывать не только основное заболевание и чувствительность патогенных микроорганизмов, но также и возраст больного, наличие беременности, индивидуальной непереносимости компонентов препарата, сопутствующих патологий и прием преп., не сочетающихся с рекомендуемым лекарством.
Также, важно помнить, что при отсутствии клинического эффекта от терапии в течении 72 часов, производится смена лекарственного ср-ва, с учетом возможной перекрёстной устойчивости.
На тяжёлые инфекции или в целях эмпирической терапии с неуточнённым возбудителем, рекомендована комбинация разных видов антибиотиков, с учетом их совместимости.
По влиянию на болезнетворные микроорганизмы, выделяют:
- бактериостатические — угнетающие жизнедеятельность, рост и размножение бактерий;
- бактерицидные антибиотики — это вещества, полностью уничтожающие возбудителя, в следствие необратимого связывания с клеточной мишенью.
Однако, такое разделение, достаточно условно, так как многие антиб. могут проявлять разную активность, в зависимости от назначенной дозировки и длительности применения.
Если пациент недавно применял противомикробное средство, необходимо избегать его повторного применения, минимум, шесть месяцев — для профилактики возникновения антибиотико-резистентной флоры.
Как развивается резистентность к лекарственным препаратам?
Наиболее часто наблюдается устойчивость вследствие мутации микроорганизма, сопровождающейся видоизменением мишени внутри клеток, на которую воздействуют разновидности антибиотиков.
Действующее вещество, назначенного ср-ва, проникает в бактериальную клетку, однако не может связаться с необходимой мишенью, так как нарушается принцип связывания по типу «ключ-замок». Следовательно, механизм подавления активности или уничтожения патологического агента не активируется.
Другим эффективным методом защиты от лекарств является синтез бактериями ферментов, разрушающих основные структуры антиб. Такой тип резистентности чаще всего возникает к бета-лактамам, за счёт продукции флорой бета-лактамаз.
Гораздо реже встречается повышение устойчивости, за счет уменьшения проницаемости клеточной мембраны, то есть лекарство проникает внутрь в слишком малых дозах, для оказания клинически значимого эффекта.
В качестве профилактики развития препаратоустойчивой флоры, необходимо также учитывать минимальную концентрацию подавления, выражающую количественную оценку степени и спектра действия, а также зависимость от времени и концентр. в крови.
Для дозо-зависимых средств (аминогликозиды, метронидазол) характерна зависимость эффективности действия от концентр. в крови и очаге инфекционно-воспалительного процесса.
Лекарства, зависящие от времени, требуют повторных введений в течение суток, для поддержания эффективной терапевтической концентр. в организме (все бета-лактамы, макролиды).
Классификация антибиотиков по механизму действия
- лекарства, ингибирующие синтезирование клеточной стенки бактерий (антибиот.пенициллинового ряда, все поколения цефалоспоринов, Ванкомицин ®);
- разрушающие нормальную организацию клетки на молекулярном уровне и препятствующие нормальному функционированию мембраны бак. клеток (Полимиксин ®);
- ср-ва, способствующие подавлению синтеза белков, тормозящие образование нуклеиновых кислот и ингибирующие синтез белка на рибосомальном уровне (препараты Хлорамфеникола, ряд тетрациклинов, макролиды, Линкомицин ® , аминогликозиды);
- ингибит. рибонуклеиновых кислот — полимеразы и др. (Рифампицин ® , хинолы, нитроимидазолы);
- ингибирующие процессы синтеза фолатов (сульфаниламиды, диаминопириды).
Классификация антибиотиков по химическому строению и происхождению
1. Природные — продукты жизнедеятельности бактерий, грибов, актиномицетов:
- Грамицидины ® ;
- Полимиксины;
- Эритромицин ® ;
- Тетрациклин ® ;
- Бензилпенициллины;
- Цефалоспорины и т.д.
2. Полусинтетические — производные природных антиб.:
- Оксациллин ® ;
- Ампициллин ® ;
- Гентамицин ® ;
- Рифампицин ® и т.д.
3. Синтетические, то есть, полученные в следствие химического синтеза:
- Левомицетин ® ;
- Амикацин ® и т.д.
Классификация антибиотиков по спектру действия и целям применения
| Действующие преимущественно на: | Антибактериальные пр. с широким спектром действ.: | Противотуберкулёзные ср-ва | |
| Грам+: | Грам-: | ||
| биосинтетические пенициллины и 1-е поколение цефалоспоринов; макролиды; линкозамиды; препараты Ванкомицина ® , Линкомицина ® . |
монобактамы; циклич. полипептиды; 3-е пок. цефалоспоринов. |
аминогликозиды; левомицетин; тетрациклин; полусинтетич. пенициллины имеющие расширенный спектр (Ампициллин ®); 2-е пок. цефалоспоринов. |
Стрептомицин ® ; Рифампицин ® ; Флоримицин ® . |
Современная классификация антибиотиков по группам: таблица
| Основная группа | Подклассы |
| Бета-лактамы | |
| 1. Пенициллины | Природные; Антистафилококковые; Антисинегнойные; С расширенным спектром действ.; Ингибиторозащищённые; Комбинированные. |
| 2. Цефалоспорины | 4-ре поколения; Анти-MRSA цефемы. |
| 3. Карбапенемы | — |
| 4. Монобактамы | — |
| Аминогликозиды | Три поколения. |
| Макролиды | Четырнадцати-членные; Пятнадцати-членные (азолы); Шестнадцати-членные. |
| Сульфаниламиды | Короткого действ.; Средней длительности действ.; Длительного действ.; Сверхдлительные; Местные. |
| Хинолоны | Нефторированные (1-е поколение); Второе; Респираторные (3-е); Четвёртое. |
| Противотуберкулёзные | Основной ряд; Группа резерва. |
| Тетрациклины | Природные; Полусинтетические. |
Не имеющие подклассов:
- Линкозамиды (линкомицин ® , клиндамицин ®);
- Нитрофураны;
- Оксихинолины;
- Хлорамфеникол (данная группа антибиотиков представлена Левомицетином ®);
- Стрептограмины;
- Рифамицины (Римактан ®);
- Спектиномицин (Тробицин ®);
- Нитроимидазолы;
- Антифолаты;
- Циклические пептиды;
- Гликопептиды (ванкомицин ® и тейкопланин ®);
- Кетолиды;
- Диоксидин;
- Фосфомицин (Монурал ®);
- Фузиданы;
- Мупироцин (Бактобан ®);
- Оксазолидиноны;
- Эверниномицины;
- Глицилциклины.
Группы антибиотиков и препараты в таблице
Пенициллины
Как и все бета-лактамные ср-ва, пенициллины имеют бактерицидный эффект. Они влияют на завершающий этап синтеза биополимеров, образующих клеточную стенку. В следствие блокировки синтеза пептидогликанов, за счёт действия на пенициллиносвязывающие ферменты, они вызывают гибель паталогической микробной клетки.
Низкий уровень токсичности для человека обусловлен отсутствием клеток-мишеней для антиб.
Механизмы бактериальной устойчивости к этим препаратам преодолены созданием защищенных средств, усиленных клавулановой кислотой, сульбактамом и т.д. Эти вещества подавляют действие бак. ферментов и защищают лекарственное средство от разрушения.
ПриродныеБензилпенициллинаБензилпенициллина Na и K соли.
| Группа | По действующему веществу выделяют препар.: | Названия |
| Феноксиметилпенициллина | Метилпенициллин ® | |
| С пролонгированным дейст. | ||
| Бензилпенициллина прокаин |
Бензилпенициллина новокаиновая соль ® . | |
| Бензилпенициллина/ Бензилпенициллина прокаин/ Бензатин бензилпенициллин | Бензициллин-3 ® . Бициллин-3 ® | |
| Бензилпенициллина прокаин/Бензатин бензилпенициллин |
Бензициллин-5 ® . Бициллин-5 ® | |
| Антистафилококковые | Оксациллина ® | Оксациллин АКОС ® , натриевая соль Оксациллина ® . |
| Пенициллиназорезистентные | Клоксапциллин ® , Алюклоксациллин ® . | |
| Обладающие расширенным спектром | Ампициллина ® | Ампициллин ® |
| Амоксициллина ® | Флемоксин солютаб ® , Оспамокс ® , Амоксициллин ® . | |
| С антисинегнойной активностью | Карбенициллина ® | Динатриевая соль карбенициллина ® , Карфециллин ® , Кариндациллин ® . |
| Уриедопенициллины | ||
| Пиперациллина ® | Пициллин ® , Пипрацил ® | |
| Азлоциллина ® | Натриевая соль азлоциллина ® , Секуропен ® , Мезлоциллин ® . | |
| Ингибиторозащищённые | Амоксициллина/клавуланат ® | Ко-амоксиклав ® , Аугментин ® , Амоксиклав ® , Ранклав ® , Энханцин ® , Панклав ® . |
| Амоксициллина сульбактам ® | Трифамокс ИБЛ ® . | |
| Амлициллина/сульбактам ® | Сулациллин ® , Уназин ® , Амписид ® . | |
| Пиперациллина/тазобактам ® | Тазоцин ® | |
| Тикарциллина/клавуланат ® | Тиментин ® | |
| Комбинация пенициллинов | Ампициллина/оксациллин ® | Ампиокс ® . |
Цефалоспорины
За счёт малой токсичности, хорошей переносимости, возможности использовать беременным женщинам, а также широкого спектра действия — цефалоспорины являются наиболее часто используемыми средствами с антибактериальным действием в терапевтической практике.
Механизм воздействия на микробную клетку аналогичен пенициллинам, однако является более устойчивым к воздействию бак. ферментов.
Преп. цефалоспоринового ряда имеют высокую биодоступность и хорошую усвояемость при любом способе введения (парентеральный, пероральный). Хорошо распределяются во внутренних органах (исключение составляет предстательная железа), крови и тканях.
Создавать клинически действенные концентрации в желчи способны только Цефтриаксон ® и Цефоперазон ® .
Высокий уровень проходимости через гематоэнцефалический барьер и эффективность при воспалении мозговых оболочек, отмечают у третьего поколения.
Единственный защищенный сульбактамом цефалоспорин- Цефоперазона/сульбактам ® . Имеет расширенный спектр воздействия на флору, за счёт высокой устойчивости к влиянию бета-лактамаз.
В таблице представлены группы антибиотиков и названия основных препаратов.
| Поколения | Препар.: | Название |
| 1-е | Цефазолинам | Кефзол ® . |
| Цефалексина ® * | Цефалексин-АКОС ® . | |
| Цефадроксила ® * | Дуроцеф ® . | |
| 2-е | Цефуроксима ® | Зинацеф ® , Цефурус ® . |
| Цефокситина ® | Мефоксин ® . | |
| Цефотетана ® | Цефотетан ® . | |
| Цефаклора ® * | Цеклор ® , Верцеф ® . | |
| Цефуроксим-аксетила ® * | Зиннат ® . | |
| 3-е | Цефотаксима ® | Цефотаксим ® . |
| Цефтриаксона ® | Рофецин ® . | |
| Цефоперазона ® | Медоцеф ® . | |
| Цефтазидима ® | Фортум ® , Цефтазидим ® . | |
| Цефоперазона/сульбактама ® | Сульперазон ® , Сульзонцеф ® , Бакперазон ® . | |
| Цефдиторена ® * | Спектрацеф ® . | |
| Цефиксима ® * | Супракс ® , Сорцеф ® . | |
| Цефподоксима ® * | Проксетил ® . | |
| Цефтибутена ® * | Цедекс ® . | |
| 4-е | Цефепима ® | Максипим ® . |
| Цефпирома ® | Кейтен ® . | |
| 5-е | Цефтобипрола ® | Зефтера ® . |
| Цефтаролина ® | Зинфоро ® . |
* Имеют оральную форму выпуска.
Карбапенемы
Являются препаратами резерва и применяются для лечения тяжёлых нозокомиальных инфекций.
Высокоустойчивы к бета-лактамазам, эффективны для терапии препаратоустойчивой флоры. При жизнеугрожающих инфекционных процессах, являются первоочередными средствами для эмпирической схемы.
Выделяют преп.:
- Дорипенема ® (Дорипрескс ®);
- Имипенема ® (Тиенам ®);
- Меропенема ® (Меронем ®);
- Эртапенема ® (Инванз ®).
Монобактамы
- Азтреонам ® .
Преп. имеет ограниченный спектр применения и назначается для устранения воспалительно-инфекционных процессов, ассоциированных Грам- бактериями. Эффективен в терапии инфек. процессов мочевыводящих путей, воспалительных заболеваний органов малого таза, кожи, септических состояниях.
Аминогликозиды
Бактерицидное воздействие на микробы зависит от уровня концентрации сред-ва в биологических жидкостях и обусловлено тем, что аминогликозиды нарушают процессы синтеза белков на рибосомах бактерий. Имеют достаточно высокий уровень токсичности и множество побочных эффектов, однако, редко становятся причиной аллергических реакций. Практически не эффективны при пероральном приёме, за счет плохой всасываемости в желудочно-кишечном тракте.
По сравнению с бета-лактамами, уровень прохождения через тканевые барьеры намного хуже. Не имеют терапевтически значимых концентраций в костях, ликворе и секрете бронхов.
| Поколения | Препар.: | Торг. название |
| 1-е | Канамицин ® | Канамицин-АКОС ® . Канамицина моносульфат ® . Канамицина сульфат ® |
| Неомицин ® | Неомицина сульфат ® | |
| Стрептомицин ® | Стрептомицина сульфат ® . Стрептомицина-хлоркальциевый комплекс ® | |
| 2-е | Гентамицин ® | Гентамицин ® . Гентамицин-АКОС ® . Гентамицин-К ® |
| Нетилмицин ® | Нетромицин ® | |
| Тобрамицин ® | Тобрекс ® . Бруламицин ® . Небцин ® . Тобрамицин ® | |
| 3-е | Амикацин ® | Амикацин ® . Амикин ® . Селемицин ® . Хемацин ® |
Макролиды
Обеспечивают торможение процесса роста и размножения патогенной флоры, обусловленное подавлением синтезирования белков на рибосомах клет. стенки бактерий. При увеличении дозировки, могут давать бактерицидный эффект.
Также, существуют комбинированные преп.:
- Пилобакт ® — комплексное сред-во для терапии хеликобактер пилори. Содержит в своём составе кларитромицин ® , омепразол ® и тинидазол ® .
- Зинерит ® – сред-во для наружного применения, с целью лечения угревой сыпи. Действующими компонентами являются эритромицин и ацетат цинка.
Сульфаниламиды
Угнетают процессы роста и размножения болезнетворных микроорганизмов, за счет структурного сходства с парааминобензойной кислотой, участвующей в жизнедеятельности бактерий.
Имеют высокий показатель резистентности к своему действию у многих представителей Грам-, Грам+. Применяются в составе комплексной терапии ревматоидных артритов, сохраняют хорошую противомалярийную активность, эффективны против токсоплазмы.
Классификация:
Для местного использования применяют Сульфатиазол серебра (Дермазин ®).
Хинолоны
За счет ингибирования ДНК-гидразы имеют бактерицидный эффект, являются концентрационнозависимыми сред-ми.
- К первому поколению относятся нефторированные хинолоны (налидиксовая, оксолиновая и пипемидиновые кислоты);
- Второе пок. представлено Грам- средствами (Ципрофлоксацин ® , Левофлоксацин ® и т.д.).;
- Третье – это, так называемые, респираторные средст. (Лево- и Спарфлоксацин ®);
Четвёртое — преп. с антианаэробной активностью (Моксифлоксацин ®).
Тетрациклины
Тетрациклин ® , чье название было присвоено отдельной группе антиб., впервые получен химическим путем в 1952 году.
Действующие вещества группы: метациклин ® , миноциклин ® , тетрациклин ® , доксициклин ® , окситетрациклин ® .
На нашем сайте Вы можете познакомиться с большинством групп антибиотиков, полными списками входящих в них препаратов, классификациями, историей и прочей важной информацией. Для этого создан раздел « » в верхнем меню сайта.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Введение
1. Классификация антибиотиков
2. Бета-лактамные антибиотики
3. Пенициллины
4. Группа цефалоспоринов
5. Группа карбапенемов
6. Группа монобактамов
7. Группа тетрациклинов
8. Группа аминогликозидов
9. Левомицетины
10. Группа гликопептидов
11. Группа линкозамидов
12. Противотуберкулезные химиопрепараты
13. Классификация противотуберкулезных препаратов Международного союза борьбы с туберкулезом
14. Полипептиды
Литература
Введение
Антибиотики -- это вещества, которые подавляют рост живых клеток, чаще всего прокариотических и простейших. Антибиотики могут быть естественными (природного) происхождения и искусственными (синтетическими и полусинтетическими).
Антибиотики природного происхождения чаще всего продуцируются актиномицетами и плесневыми грибами, но их также можно получить из бактерий (полимиксины), растений (фитонциды) и тканей животных и рыб.
Антибиотики, которые подавляют рост и размножение бактерий используются в качестве лекарственных препаратов. Широкое использование антибиотики получили и в онкологической практике, в качестве цитостатических (противоопухолевых) препаратов. При лечении заболеваний вирусной этиологии, применение антибиотиков не целесообразно, так как они не способны воздействовать на вирусы. Однако, было отмечено, что ряд антибиотиков (тетрациклины) способны воздействовать на крупные вирусы.
Антибактериальные препараты -- это синтетические препараты, не имеющие природных аналогов и оказывающие сходное с антибиотиками подавляющее влияние на рост бактерий.
Изобретение антибиотиков можно назвать революцией в медицине. Первыми антибиотиками были пенициллин и стрептомицин.
1. Классификация антибиотиков
По характеру воздействия на бактериальную клетку:
1. бактериостатические препараты (останавливают рост и размножение бактерий)
2. бактерицидные препараты (уничтожают бактерии)
По способу получения различают антибиотики:
1. природные
2. синтетические
3. полусинтетические
По направленности действия различают:
1. антибактериальные
2. противоопухолевые
3. противогрибковые
По спектру действия различают:
1. антибиотики широкого спектра действия
2. антибиотики узкого спектра действия
По химической структуре:
1. Бета-лактамные антибиотики
Пенициллины -- вырабатываются колониями плесневого грибка Penicillinum. Различают: биосинтетические (пенициллин G -- бензилпенициллин), аминопенициллины (амоксициллин, ампициллин, бекампициллин) и полусинтетические (оксациллин, метициллин, клоксациллин, диклоксациллин, флуклоксациллин) пенициллины.
Цефалоспорины -- используются по отношению к пенициллинустойчивым бактериям. Различают цефалоспорины: 1-го (цепорин, цефалексин), 2-го (цефазолин, цефамезин), 3-го (цефтриаксон, цефотаксим, цефуроксим) и 4-го (цефепим, цефпиром) поколений.
Карбапенемы -- антибиотики широкого спектра действия. Структура карбапенемов обуславливает их высокую резистентность к бета-лактамазам. К карбапенемам относятся: меропенем (меронем) и имипинем.
Монобактамы (азтреонам)
2. Макролиды -- антибиотики со сложной циклической структурой, обладающие бактериостатическим действием. По сравнению с другими антибиотиками являются менее токсичными. К ним относятся: эритромицин, олеандомицин, рокситромицин, азитромицин (сумамед), кларитромицин и др. Также к макролидам относятся: азалиды и кетолиды.
3. Тетрациклины -- используются для лечения инфекций дыхательных и мочевыводящих путей, лечения тяжелых инфекций типа сибирской язвы, туляремии, бруцеллёза. Обладает бактериостатическим действием. Относятся к классу поликетидов. Среди них различают: природные (тетрациклин, окситетрациклин) и полусинтетические (метациклин, хлортетрин, доксициклин) тетрациклины.
4. Аминогликозиды -- препараты данной группы антибиотиков высокотоксичные. Используются для лечения тяжелых инфекций типа заражения крови или перитонитов. Обладает бактерицидным действием. Аминогликозидыактивны в отношении к грамотрицательным аэробным бактериям. К ним относятся: стрептомицин, гентамицин, канамицин, неомицин, амикацин и др.
5. Левомицетины -- При использовании антибиотиков данной группы, существует риск возникновения серьезных осложнений -- поражении костного мозга, вырабатывающего клетки крови. Обладает бактериостатическим действием.
6. Гликопептидные антибиотики нарушают синтез клеточной стенки бактерий. Обладает бактерицидным действием, однако возможно бактериостатическое действие антибиотиков данной группы в отношении к энтерококкам, стрептококкам и стафилококкам. К ним относятся: ванкомицин, тейкопланин, даптомицин и др.
7. Линкозамиды обладают бактериостатическим действием. В высоких концентрациях в отношении высокочувствительных микроорганизмов могут проявлять бактерицидный эффект. К ним относятся: линкомицин и клиндамицин
8. Противотуберкулёзные препараты -- Изониазид, Фтивазид, Салюзид, Метазид, Этионамид, Протионамид.
9. Полипептиды -- антибиотики данной группы в своей молекуле содержать остатки полипептидных соединений. К ним относятся: грамицидин, полимиксины М и В, бацитрацин, колистин;
10. К полиенам относятся: амфотерицин В, нистатин, леворин, натамицин
11. Антибиотики разных групп -- Рифамицин, Ристомицина сульфат, Фузидин-натрий и др.
12. Противогрибковые препараты -- вызывают гибель клеток грибков, разрушая их мембранную структуру. Обладают литическим действием.
13. Противолепрозные препараты -- Диафенилсульфон, Солюсульфон, Диуцифон.
14. Антрациклинновые антибиотики -- к ним относятся противоопухолевые антибиотики -- доксорубицин, карминомицин, рубомицин, акларубицин.
2. Бета-лактамные антибиотики
К в-лактамным антибиотикам (в-лактамам), которые объединяет наличие в структуре в-лактамного кольца, относятся пенициллины, цефалоспорины, карбапенемы и монобактамы, обладающие бактерицидным действием. Сходство химической структуры предопределяет одинаковый механизм действия всех в-лактамов (нарушение синтеза клеточной стенки бактерий), а также перекрестную аллергию к ним у некоторых пациентов.
Пенициллины, цефалоспорины и монобактамы чувствительны к гидролизующему действию особых ферментов - в-лактамаз, вырабатываемых рядом бактерий. Карбапенемы характеризуются значительно более высокой устойчивостью к в-лактамазам.
С учетом высокой клинической эффективности и низкой токсичности в-лактамные антибиотики составляют основу антимикробной химиотерапии на современном этапе, занимая ведущее место при лечении большинства инфекций.
3. Пенициллины
Пенициллины являются первыми антимикробными препаратами, разработанными на основе биологически активных субстанций, продуцируемых микроорганизмами. Родоначальник всех пенициллинов, бензилпенициллин, был получен в начале 40-х годов XX столетия. В настоящее время группа пенициллинов включает более десяти антибиотиков, которые в зависимости от источников получения, особенностей строения и антимикробной активности подразделяются на несколько подгрупп (табл. 1)
Общие свойства:
1. Бактерицидное действие.
2. Низкая токсичность.
3. Выведение в основном через почки.
4. Широкий диапазон дозировок.
Перекрестная аллергия между всеми пенициллинами и частично цефалоспоринами и карбапенемами.
Природные пенициллины . К природным пенициллинам относится, по существу, только бензилпенициллин. Однако, исходя из спектра активности, пролонгированные (бензилпенициллинпрокаин, бензатинбензилпенициллин) ипероральные(феноксиметилпенициллин,бензатинфеноксиметилпенициллин) производные также можно отнести к этой группе. Все они разрушаются в-лактамазами, поэтому их нельзя использовать для терапии стафилококковых инфекций, так как в большинстве случаев стафилококки вырабатывают в-лактамазы.
Полусинтетические пенициллины:
Антистафилококковые пенициллины
Пенициллины с расширенным спектром активности
Антисинегнойные пенициллины
4. Группа цефалоспоринов
Цефалоспорины являются представителями в-лактамов. Считаются одним из самых обширных классов АМП. За счет своей низкой токсичности и высокой эффективности цефалоспорины используют гораздо чаще других АМП. Антимикробная активность и фармакокинетическая характеристика определяют использование того или иного антибиотика группы цефалоспоринов. Поскольку цефалоспорины и пенициллины имеют структурное сходство, препараты данных групп характеризуются одинаковым механизмом антимикробного действия, а также перекрестной аллергией у некоторых пациентов.
Существует 4 поколения цефаллоспоринов:
І поколение - цефазолин (парентеральное использование); цефалексин, цефадроксил (пероральное использование)
ІІ поколение - цефуроксим (парентерально); цефуроксим аксетил, цефаклор (перорально)
ІІІ поколение - цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефоперазон/сульбактам (парентерально); цефиксим, цефтибутен (перорально)
IV поколение - цефепим (парентерально).
Механизм действия . Действие цефалоспоринов бактрицидное. Под влияние цефалоспоринов попадают пенициллиносвязывающие белки бактерий, выполняющие роль ферментов на конечном этапе синтеза пептидогликана (биополимер - основной компонент клеточной стенки бактерий). В результате блокирования синтеза пептидогликана бактерия гибнет.
Спектр активности . Цефалоспорины от I к III поколению характеризуются тенденцией к расширению круга активности, а также повышением уровня антимикробной активности по отношению грамотрицательных микроорганизмов и понижением уровня активности по отношению грамположительных бактерий.
Общее для всех цефалоспоринов - это отсутствие весомой активности по отношению L.monocytogenes, MRSA и энтерококков. К цефалоспоринам проявляют меньшую чувствительность КНС, по сравнению с S.aureus.
Цефалоспорины I поколения . Имеют сходный антимикробный спектр активности со следующим отличием: действуют более сильно препараты, предназначенные для парентерального введения (цефазолин), нежели препараты для перорального приема (цефадроксил, цефалексин). Действию антибиотиков подвержены метициллиночувствительные Staphylococcus spp. и Streptococcus spp. (S.pneumoniae, S.pyogenes). Цефалоспорины І поколения отличаются меньшей антипневмококковой активности, по сравнению с аминопенициллинами и большинством цефалоспоринов последующих поколений. Цефалоспорины вообще не действуют на листерии и энтерококки, что является клинически важной особенностью данного класса антибиотиков. У цефалоспоринов выявлена устойчивость к действию стафилококковых в-лактамаз, но несмотря на это у отдельных штаммов (гиперпродуцентов этих ферментов), может проявляться к ним умеренная чувствительность. Цефалоспорины І поколения и пенициллины не активны в отношении пневмококков. У цефалоспоринов I поколения узкий спектр действия и невысокий уровень активности по отношению грамотрицательных бактерий. Их действие распространятся на Neisseria spp., однако клиническое значение данного факта ограничено. Клинически незначима активность цефалоспоринов І поколения в отношении M.сatarrhalis и H.influenzae. На M.сatarrhalis действуют природно достаточно активно, но проявляют чувствительность к гидролизу в-лактамазами, продуцирующими практически 100-% штаммов. Подвержены влиянию цефалоспоринов І поколения представители семейства Enterobacteriaceae: P.mirabilis, Salmonella spp., Shigella spp., E.coli, при чем клиническое значение отсутствует в активности по отношению шигелл и сальмонелл. Штаммы P.mirabilis и E.coli, которые провоцируют внебольничные (особенно нозокомиальные) инфекции, характеризуются широко распространенной приобретенной устойчивостью, обусловленной продукцией в-лактамаз расширенного и широкого спектра действия.
У других энтеробактерий, неферментирующих бактерий и Pseudomonas spp. выявлена резистентность.
B.fragilis и родственные микроорганизмы проявляют устойчивость, а представители ряда анаэробов - чувствительность к действию цефалоспоринов І поколения.
Цефалоспорины II поколения . Цефуроксим и цефаклор - два представителя этого поколения - отличаются между собой: имея сходный антимикробный спектр действия, у цефуроксима, по сравнению с цефаклором, выявлена большая активность по отношению Staphylococcus spp. и Streptococcus spp. Оба препарата не проявляют активность в отношении листерий, энтерококков и MRSA.
У пневмококков проявляется ПР к пенициллину и цефалоспоринам II поколения. Представители цефалоспоринов ІІ поколения отличаются более расширенным спектром воздействия на грамотрицательные микроорганизмы, чем цефалоспорины І поколения. Как цефуроксим, так и цефаклор проявляют активность по отношению Neisseria spp., но только у действия цефуроксима на гонококки обозначена клиническая активность. На Haemophilus spp. и M. Catarrhalis влияет более сильно цефуроксим, поскольку проявляет устойчивость к гидролизу их в-лактамазами, а данные ферменты частично разрушают цефаклор. Из представителей семейства Enterobacteriaceae подвержены воздействию препаратов не только P.mirabilis, Salmonella spp., Shigella spp., E.coli, но и C.diversus, P.vulgaris, Klebsiella spp. При продукции микроорганизмами, перечисленными выше, в-лактамаз широкого спектра у них сохраняется чувствительность к цефуроксиму. У цефаклора и цефуроксима есть особенность: их разрушают в-лактамазы расширенного спектра. У некоторых штаммов P.rettgeri, P.stuartii, M.morganii, Serratia spp., C.freundii, Enterobacter spp. может проявляться in vitro умеренная чувствительность к цефуроксиму, однако нет смысла использовать этот препарат при лечении инфекций, возбудителями которых являются вышеперечисленные бактерии. Действие цефалоспоринов II поколения не распространяется на анаэробы группы B.fragilis, псевдомонады и другие неферментирующие микроорганизмы.
Цефалоспорины III поколения . У цефалоспоринов III поколения наравне с общими чертами существуют и определенные особенности. Цефтриаксон и цефотаксим являются базовыми АМП данной группы и практически не отличаются друг от друга по своим антимикробным действиям. Оба препарата активно действуют на Streptococcus spp., и при этом у существенной части пневмококков, а также у зеленящихся стрептококков, проявляющих резистентность к пенициллину, сохраняется чувствительность к цефтриаксону и цефотаксиму. Действию цефотаксима и цефтриаксона подвержены S.aureus (кроме MRSA), в несколько меньшей степени - КНС. У коринебактерий (кроме C.jeikeium), как правило, проявляется чувствительность. Устойчивость проявляют B.сereus, B.antracis, L.monocytogenes, MRSA и энтерококки. Высокую активность цефтриаксон и цефотаксим демонстрируют по отношению H.influenzae, M.catarrhalis, гонококков и менингококков, включая штаммы с пониженной чувствительностью к действию пенициллина, вне зависимости от механизма устойчивости. Практически все представители семейства Enterobacteriaceae, в т.ч. микроорганизмы, которые продуцируют в-лактамазы широкого спектра, подвержены активному природному воздействию цефотаксима и цефтриаксона. E.coli и Klebsiella spp. обладают устойчивостью, чаще всего обусловленной продукцией БЛРС. Гиперпродукция хромосомных в-лактамаз класса С обычно становится причиной устойчивости P.rettgeri, P.stuartii, M.morganii, Serratia spp., C.freundii, Enterobacter spp.
Иногда активность цефотаксима и цефтриаксона in vitro проявляется по отношению определенных штаммов P.aeruginosa, др. неферментирующих микроорганизмов, а также B.fragilis, но этого не достаточно для того, чтобы их можно было применять при лечении соответствующих инфекций.
Между цефтазидимом, цефоперазон и цефотаксимом, цефтриаксоном существуют сходства по основным антимикробным свойствам. Отличительные характеристики цефтазидима и цефоперазона от цефотаксима и цефтриаксона:
Проявляют высокую чувствительность к гидролизу БЛРС;
Проявляют существенно меньшую активность по отношению стрептококков, в первую очередь S.pneumoniae;
Выраженная активность (особенно у цефтазидима) по отношению P.aeruginosa и др. неферментирующих микроорганизмов.
Отличия цефиксима и цефтибутена от цефотаксима и цефтриаксона:
Оба препарата не действуют или мало действуют на P.rettgeri, P.stuartii, M.morganii, Serratia spp., C.freundii, Enterobacter spp.;
Цефтибутен малоактивен по отношению зеленящих стрептококков и пневмококков мало подвержены действию цефтибутена;
Нет значимой активности по отношению Staphylococcus spp.
Цефалоспорины IV поколения . Между цефепимом и цефалоспоринами III поколения много общего по многим параметрам. Однако особенности химической структуры позволяют цефепиму проникать с большей уверенностью через внешнюю мембрану грамотрицательных микроорганизмов, а также иметь относительную устойчивость к гидролизу хромосомными в-лактамазами класса С. Потому вместе со своими свойствами, отличающими базовые цефалоспорины ІІІ поколения (цефтриаксон, цефотаксим), цефепим обладает следующими особенностями:
Высокая активность по отношению неферментирующих микроорганизмов и P.aeruginosa;
Повышенная устойчивость к гидролизу в-лактамаз расширенного спектра (этот факт не до конца определяет свое клиническое значение);
Влияние на следующие микроорганизмы-гиперпродуценты хромосомных в-лактамаз класса С: P.rettgeri, P.stuartii, M.morganii, Serratia spp., C.freundii, Enterobacter spp.
Ингибиторозащищенные цефалоспорины . Цефоперазон/сульбактам - единственный представитель данной группы в-лактамов. В сравнении с цефоперазоном, комбинированный препарат обладает расширенным спектром действия за счет влияния на анаэробные микроорганизмы. Также действию препарата подвержены большинство штаммов энтеробактерий, которые продуцируют в-лактамазы расширенного и широкого спектра. Антибактериальная активность сульбактама позволяет данному АМП проявлять высокую активность по отношению Acinetobacter spp.
Фармакокинетика . У пероральных цефалоспоринов установлена хорошая всасываемость в ЖКТ. Конкретный препарат отличается своей биодоступностью, варьирующей между 40-50% (у цефиксима) и 95 % (у цефаклора, цефадроксила и цефалексина). Наличие пищи может несколько замедлять всасываемость цефтибутена, цефиксима и цефаклора. Пища помогает во время всасывания цефуроксима аксетила высвобождать активный цефуроксим. При введении в/м наблюдается хорошее всасывание парентеральных цефалоспоринов. Распределение цефалоспоринов осуществляется во многих органах (кроме предстательной железы), тканях и секретах. В перитонеальной, плевральной, перикардиальной и синовиальной жидкостях, в костях, мягких тканях, коже, мышцах, печени, почках и легких отмечаются высокие концентрации. Цефоперазон и цефтриаксон создают в желчи самые высокие уровни. У цефалоспоринов, в особенности цефтазидима и цефуроксима отмечается способность хорошо проникать во внутриглазную жидкость, и при этом не создавать терапевтические уровни в задней камере глаза. Цефалоспорины ІІІ поколения (цефтазидим, цефтриаксон, цефотаксим) и ІV поколения (цефепим) обладают в наибольшей мере способностью проходить через ГЭБ, а также создавать терапевтические концентрации в СМЖ. Цефуроксим умеренно преодолевает ГЭБ исключительно в случае воспаления оболочек мозга.
У большинства цефалоспоринов (кроме цефотаксима, биотрасформирующегося с образованием активного метаболита) отсутствует способность метаболизироваться. Вывод препаратов осуществляется преимущественно через почки, при этом создавая очень высокие концентрации в моче. У цефтриаксона и цефоперазона двойной путь выведения - печенью и почками. У большинства цефалоспоринов период полувыведения от 1 до 2 часов. Цефтибутен, цефиксим отличаются более длительным периодом - 3-4 часа, у цефтриаксона он увеличивается до 8,5 часов. Благодаря этому показателю данные препараты можно принимать 1 раз в сутки. Почечная недостаточность влечет за собой коррекцию режима дозирования антибиотиков группы цефалоспоринов (кроме цефоперазона и цефтриаксона).
Цефалоспорины I поколения . В основном на сегодняшний день цефазолин применяют в качестве периоперационной профилактики в хирургии. Также его применяют при инфекциях мягких тканей и кожи.
Поскольку у цефазолина узкий спектр активности, а среди потенциальных возбудителей распространена резистентность к действию цефалоспоринов, то у рекомендаций к применению цефазолина для лечения инфекций дыхательных путей и МВП сегодня нет достаточных обоснований.
Цефалексин применяют при лечении стрептококкового тонзиллофарингита (как препарат второго ряда), а также внебольничных инфекций мягких тканей и кожи легкой и средней степени тяжести.
Цефалоспорины II поколения
Цефуроксим используется:
При внебольничной пневмонии, требующей госпитализации;
При внебольничных инфекциях мягких тканей и кожи;
При инфекциях МВП (пиелонефрите средней и тяжелой степени тяжести); антибиотик цефалоспорин тетрациклин противотуберкулезный
В качестве периоперационной профилактики в хирургии.
Цефаклор, цефуроксим аксетил используется:
При инфекциях ВДП и НДП (внебольничной пневмонии, обострении хронического бронхита, остром синусите, ОСО);
При внебольничных инфекциях мягких тканей и кожи легкой, средней степени тяжести;
Инфекциях МВП (остром цистите и пиелонефрите у детей, пиелонефрите у женщин в период лактации, пиелонефрите легкой и средней степени тяжести).
Цефуроксим аксетил и цефуроксим можно использовать как ступенчатую терапию.
Цефалоспорины III поколения
Цефтриаксон, цефотаксим применяют при:
Внебольничных инфекциях - острой гонореи, ОСО (цефтриаксон);
Тяжелых нозокомиальных и внебольничных инфекциях - сепсисе, менингите, генерализованном сальмонеллезе, инфекциях органов малого таза, интраабдоминальных инфекциях, тяжелых формах инфекций суставов, костей, мягких тканей и кожи, тяжелых формах инфекций МВП, инфекций НДП.
Цефоперазон, цефтазидим назначают при:
Лечении тяжелых внебольничных и нозокомиальных инфекций различной локализации в случае подтвержденного или возможного этиологического воздействия P.aeruginosa и др. неферментирующих микроорганизмов.
Лечении инфекций на фоне иммунодефицита и нейтропении (в т.ч. нейтропенической лихорадки).
Цефалоспорины ІІІ поколения могут применяться парентерально в виде монотерапии или совместно с антибиотиками др. групп.
Цефтибутен, цефиксим эффективны:
Приинфекциях МВП: остром цистите и пиелонефрите у детей, пиелонефрите у женщин в период беременности и кормления грудью, пиелонефрите легкой и средней степени тяжести;
В роли перорального этапа ступенчатой терапии разных тяжелых нозокомиальных и внебольничных инфекций, вызванных грамотрицательными бактериями, после получения стойкого эффекта от ЛС, предназначенных для парентерального приема;
При инфекциях ВДП и НДП (прием цефтибутена в случае возможной пневмококковой этиологии не рекомендуется).
Цефоперазон/сульбактам применяют:
При лечении тяжелых (в основном нозокомиальных) инфекций, вызванных смешанной (аэробно-анаэробной) и полирезистентной микрофлорой - сепсиса, инфекций НДП (эмпиемы плевры, абсцессе легкого, пневмонии), осложненных инфекций МВП, интраабдоминальных инфекций малого таза;
При инфекциях на фоне нейтропении, а также др. иммунодефицитных состояний.
Цефалоспорины IV поколения . Применяют при тяжелых, в основном нозокомиальных, инфекциях, спровоцированных полирезистентной микрофлорой:
Интраабдоминальные инфекции;
Инфекции суставов, костей, кожи и мягких тканей;
ОсложненныеинфекцииМВП;
Инфекции НДП (эмпиема плевры, абсцесс легкого, пневмония).
Также цефалоспорины IV поколения эффективны при лечении инфекций на фоне нейтропении, а также др. иммунодефицитных состояний.
Противопоказания
Нельзя применять при аллергических реакциях на цефалоспорины.
5. Группа карбапенемов
Карбапенемы (имипенем и меропенем) относятся к в-лактамам. По сравнению с пенициллинами и цефалоспоринами , они более устойчивы к гидролизующему действию бактериальных в- лактамаз , в том числе БЛРС , и обладают более широким спектром активности. Применяются при тяжелых инфекциях различной локализации, включая нозокомиальные , чаще как препараты резерва, но при угрожающих жизни инфекциях могут быть рассмотрены в качестве первоочередной эмпирической терапии.
Механизм действия . Карбапенемы оказывают мощное бактерицидное действие, обусловленное нарушением образования клеточной стенки бактерий. По сравнению с другими в-лактамами карбапенемы способны быстрее проникать через наружную мембрану грамотрицательных бактерий и, кроме того, оказывать в отношении них выраженный ПАЭ.
Спектр активности . Карбапенемы действуют на многие грамположительные, грамотрицательные и анаэробные микроорганизмы.
К карбапенемам чувствительны стафилококки (кроме MRSA ), стрептококки, включая S.pneumoniae (по активности в отношении АРП карбапенемы уступаютванкомицину ), гонококки, менингококки. Имипенем действует на E.faecalis .
Карбапенемы высокоактивны в отношении большинства грамотрицательных бактерий семейства Enterobacteriaceae (кишечная палочка, клебсиелла, протей, энтеробактер, цитробактер, ацинетобактер, морганелла), в том числе в отношении штаммов, резистентных к цефалоспоринам III-IV поколения и ингибиторозащищенным пенициллинам. Несколько ниже активность в отношении протея, серрации, H.influenzae . Большинство штаммов P.aeruginosa изначально чувствительны, но в процессе применения карбапенемов отмечается нарастание резистентности. Так, по данным многоцентрового эпидемиологического исследования, проведенного в России в 1998-1999 гг., резистентность к имипенему нозокомиальных штаммов P.aeruginosa в ОРИТ составила 18,8%.
Карбапенемы относительно слабо действуют на B.cepacia , устойчивым является S.maltophilia .
Карбапенемы высокоактивны в отношении спорообразующих (кроме C.difficile ) и неспорообразующих (включая B. fragilis ) анаэробов.
Вторичная устойчивость микроорганизмов (кроме P.aeruginosa ) к карбапенемам развивается редко. Для устойчивых возбудителей (кроме P.aeruginosa ) характерна перекрестная резистентность к имипенему и меропенему.
Фармакокинетика . Карбапенемы применяются только парентерально. Хорошо распределяются в организме, создавая терапевтические концентрации во многих тканях и секретах. При воспалении оболочек мозга проникают через ГЭБ, создавая концентрации в СМЖ, равные 15-20% уровня в плазме крови. Карбапенемы не метаболизируются, выводятся преимущественно почками в неизмененном виде, поэтому при почечной недостаточности возможно значительное замедление их элиминации.
В связи с тем, что имипенем инактивируется в почечных канальцах ферментом дегидропептидазой I и при этом не создается терапевтических концентраций в моче, он используется в комбинации с циластатином, который является селективным ингибитором дегидропептидазы I.
При проведении гемодиализа карбапенемы и циластатин быстро удаляются из крови.
Показания :
1. Тяжелые инфекции, преимущественно нозокомиальные, вызванные полирезистентной и смешанной микрофлорой;
2. И нфекции НДП (пневмония, абсцесс легкого, эмпиема плевры);
3. Осложненные инфекции МВП ;
4. И нтраабдоминальные инфекции ;
5. И нфекции органов малого таза ;
6. С епсис ;
7. И нфекции кожи и мягких тканей ;
8. Инфекции костей и суставов (только имипенем);
9. Э ндокардит (только имипенем);
10. Бактериальные инфекции у пациентов с нейтропенией;
11. Менингит (только меропенем).
Противопоказания . Аллергическая реакция на карбапенемы. Имипенем/циластатин нельзя применять также при аллергической реакции на циластатин.
6. Группа монобактамов
Из монобактамов, или моноциклических в-лактамов, в клинической практике применяется один антибиотик - азтреонам . Он имеет узкий спектр антибактериальной активности и используется для лечения инфекций, вызванных аэробной грамотрицательной флорой.
Механизм действия. Азтреонам обладает бактерицидным эффектом, который связан с нарушением образования клеточной стенки бактерий.
Спектр активности . Своеобразие антимикробного спектра действия азтреонама обусловлено тем, что он устойчив ко многим в-лактамазам, продуцируемым аэробной грамотрицательной флорой, и в то же время разрушается в-лактамазами стафилококков, бактероидов и БЛРС.
Клиническое значение имеет активность азтреонама в отношении многих микроорганизмов семейства Enterobacteriaceae (E.coli , энтеробактер, клебсиелла, протей, серрация, цитробактер, провиденция, морганелла) и P.aeruginosa , в том числе в отношении нозокомиальных штаммов, устойчивых к аминогликозидам,уреидопенициллинам и цефалоспоринам.
Азтреонам не действует на ацинетобактер, S.maltophilia , B.cepacia , грамположительные кокки и анаэробы.
Фармакокинетика. Азтреонам применяется только парентерально. Распределяется во многих тканях и средах организма. Проходит через ГЭБ при воспалении оболочек мозга, через плаценту и проникает в грудное молоко. Очень незначительно метаболизируется в печени, экскретируется преимущественно почками, на 60-75% в неизмененном виде. Период полувыведения при нормальной функции почек и печени составляет 1,5-2 ч, при циррозе печени может увеличиваться до 2,5-3,5 ч, при почечной недостаточности - до 6-8 ч. При проведении гемодиализа концентрация азтреонама в крови понижается на 25-60%.
Показания. Азтреонам является препаратом резерва для лечения инфекций различной локализации, вызванных аэробными грамотрицательными бактериями:
1. инфекции НДП (внебольничная и нозокомиальная пневмония);
2. интраабдоминальные инфекции;
3. инфекции органов малого таза;
4. инфекции МВП;
5. инфекции кожи, мягких тканей, костей и суставов;
6. сепсис.
Учитывая узкий антимикробный спектр действия азтреонама, при эмпирической терапии тяжелых инфекций его следует назначать в сочетании с АМП, активными в отношении грамположительных кокков (оксациллин, цефалоспорины, линкозамиды, ванкомицин) и анаэробов (метронидазол).
Противопоказания. Аллергические реакции на азтреонам в анамнезе.
7. Группа тетрациклинов
Тетрациклины являются одним из ранних классов АМП, первые тетрациклины были получены в конце 40-х годов. В настоящее время в связи с появлением большого количества резистентных к тетрациклинам микроорганизмов и многочисленными НР, которые свойственны этим препаратам, их применение ограничено. Наибольшее клиническое значение тетрациклины (природный тетрациклин и полусинтетический доксициклин) сохраняют при хламидийных инфекциях, риккетсиозах, некоторых зоонозах, тяжелой угревой сыпи.
Механизм действия. Тетрациклины обладают бактериостатическим эффектом, который связан с нарушением синтеза белка в микробной клетке.
Спектр активности. Тетрациклины считаются АМП с широким спектром антимикробной активности, однако в процессе их многолетнего использования многие бактерии приобрели к ним резистентность.
Среди грамположительных кокков наиболее чувствителен пневмококк (за исключением АРП). В то же время устойчивы более 50% штаммов S.pyogenes , более 70% нозокомиальных штаммов стафилококков и подавляющее большинство энтерококков. Из грамотрицательных кокков наиболее чувствительны менингококки иM.catarrhalis , а многие гонококки резистентны.
Тетрациклины действуют на некоторые грамположительные и грамотрицательные палочки - листерии, H.influenzae, H.ducreyi , иерсинии, кампилобактеры (включаяH.pylori ), бруцеллы, бартонеллы, вибрионы (включая холерный), возбудителей паховой гранулемы, сибирской язвы, чумы, туляремии. Большинство штаммов кишечной палочки, сальмонелл, шигелл, клебсиелл, энтеробактера устойчивы.
Тетрациклины активны в отношении спирохет, лептоспир, боррелий, риккетсий, хламидий, микоплазм, актиномицетов, некоторых простейших.
Среди анаэробной флоры к тетрациклинам чувствительны клостридии (кроме C.difficile ), фузобактерии, P.acnes . Большинство штаммов бактероидов устойчивы.
Фармакокинетика. При приеме внутрь тетрациклины хорошо всасываются, причем доксициклин лучше, чем тетрациклин. Биодоступность доксициклина не изменяется, а тетрациклина - в 2 раза уменьшается под влиянием пищи. Максимальные концентрации препаратов в сыворотке крови создаются через 1-3 ч после приема внутрь. При в/в введении быстро достигаются значительно более высокие концентрации в крови, чем при приеме внутрь.
Тетрациклины распределяются во многих органах и средах организма, причем доксициклин создает более высокие тканевые концентрации, чем тетрациклин. Концентрации в СМЖ составляют 10-25% уровня в сыворотке крови, концентрации в желчи в 5-20 раз выше, чем в крови. Тетрациклины обладают высокой способностью проходить через плаценту и проникать в грудное молоко.
Экскреция гидрофильного тетрациклина осуществляется преимущественно почками, поэтому при почечной недостаточности его выведение значительно нарушается. Более липофильный доксициклин выводится не только почками, но и ЖКТ, причем у пациентов с нарушением функции почек этот путь является основным. Доксициклин имеет в 2-3 раза более длительный период полувыведения по сравнению с тетрациклином. При гемодиализе тетрациклин удаляется медленно, а доксициклин не удаляется вообще.
Показания:
1. Хламидийные инфекции (пситтакоз, трахома, уретрит, простатит, цервицит).
2. Микоплазменные инфекции.
3. Боррелиозы (болезнь Лайма, возвратный тиф).
4. Риккетсиозы (Ку-лихорадка, пятнистая лихорадка Скалистых гор, сыпной тиф).
5. Бактериальные зоонозы: бруцеллез, лептоспироз, сибирская язва, чума, туляремия (в двух последних случаях - в сочетании со стрептомицином илигентамицином).
6. Инфекции НДП: обострение хронического бронхита, внебольничная пневмония.
7. Кишечные инфекции: холера, иерсиниоз.
8. Гинекологические инфекции: аднексит, сальпингоофорит (при тяжелом течении- в сочетании с в-лактамами, аминогликозидами, метронидазолом).
9. Угревая сыпь.
10. Розовые угри.
11. Раневая инфекция после укусов животных.
12. ИППП: сифилис (при аллергии к пенициллину), паховая гранулема, венерическая лимфогранулема.
13. Инфекции глаз.
14. Актиномикоз.
15. Бациллярный ангиоматоз.
16. Эрадикация H.pylori при язвенной болезни желудка и двенадцатиперстной кишки (тетрациклин в сочетании с антисекреторными ЛС, висмута субцитратом и другими АМП).
17. Профилактика тропической малярии.
Противопоказания:
Возраст до 8 лет.
Беременность.
Кормление грудью.
Тяжелая патология печени.
Почечная недостаточность (тетрациклин).
8. Группа аминогликозидов
Аминогликозиды являются одним из ранних классов антибиотиков. Первый аминогликозид - стрептомицин был получен в 1944 г. В настоящее время выделяют три поколения аминогликозидов.
Основное клиническое значение аминогликозиды имеют при лечении нозокомиальных инфекций, вызванных аэробными грамотрицательными возбудителями, а также инфекционного эндокардита. Стрептомицин и канамицин используют при лечении туберкулеза. Неомицин как наиболее токсичный среди аминогликозидов применяется только внутрь и местно.
Аминогликозиды обладают потенциальной нефротоксичностью, ототоксичностью и могут вызывать нервно-мышечную блокаду. Однако учет факторов риска, однократное введение всей суточной дозы, короткие курсы терапии и ТЛМ могут уменьшить степень проявления НР.
Механизм действия . Аминогликозиды оказывают бактерицидное действие, которое связано с нарушением синтеза белка рибосомами. Степень антибактериальной активности аминогликозидов зависит от их максимальной (пиковой) концентрации в сыворотке крови. При совместном использовании с пенициллинами или цефалоспоринаминаблюдается синергизм в отношении некоторых грамотрицательных и грамположительных аэробных микроорганизмов.
Спектр активности . Для аминогликозидов II и III поколения характерна дозозависимая бактерицидная активность в отношении грамотрицательных микроорганизмов семействаEnterobacteriaceae (E.coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp. и др.), а также неферментирующих грамотрицательных палочек (P.aeruginosa, Acinetobacter spp.). Аминогликозиды активны в отношении стафилококков, кроме MRSA. Стрептомицин и канамицин действуют на M.tuberculosis , в то время как амикацин более активен в отношении M.avium и других атипичных микобактерий. Стрептомицин и гентамицин действуют на энтерококки. Стрептомицин активен против возбудителей чумы, туляремии, бруцеллеза.
Аминогликозиды неактивны в отношении S.pneumoniae , S.maltophilia , B.cepacia , анаэробов (Bacteroides spp., Clostridium spp. и др.). Более того, резистентностьS.pneumoniae , S.maltophilia и B.cepacia к аминогликозидам может быть использована при идентификации этих микроорганизмов.
Несмотря на то, что аминогликозиды in vitro активны в отношении гемофил, шигелл, сальмонелл, легионелл, клиническая эффективность при лечении инфекций, вызванных этими возбудителями, не была установлена.
Фармакокинетика . При приеме внутрь аминогликозиды практически не всасываются, поэтому применяются парентерально (кроме неомицина). После в/м введения всасываются быстро и полностью. Пиковые концентрации развиваются через 30 мин после окончания в/в инфузии и через 0,5-1,5 ч после в/м введения.
Пиковые концентрации аминогликозидов варьируют у различных пациентов, поскольку зависят от объема распределения. Объем распределения, в свою очередь, зависит от массы тела, объема жидкости и жировой ткани, состояния пациента. Например, у пациентов с обширными ожогами, асцитом объем распределения аминогликозидов повышен. Наоборот, при дегидратации или мышечной дистрофии он уменьшается.
Аминогликозиды распределяются во внеклеточной жидкости, включая сыворотку крови, экссудат абсцессов, асцитическую, перикардиальную, плевральную, синовиальную, лимфатическую и перитонеальную жидкости. Способны создавать высокие концентрации в органах с хорошим кровоснабжением: печени, легких, почках (где они накапливаются в корковом веществе). Низкие концентрации отмечаются в мокроте, бронхиальном секрете, желчи, грудном молоке. Аминогликозиды плохо проходят через ГЭБ. При воспалении мозговых оболочек проницаемость несколько увеличивается. У новорожденных в СМЖ достигаются более высокие концентрации, чем у взрослых.
Аминогликозиды не метаболизируются, выводятся почками путем клубочковой фильтрации в неизмененном виде, создавая высокие концентрации в моче. Скорость экскреции зависит от возраста, функции почек и сопутствующей патологии пациента. У больных с лихорадкой она может увеличиваться, при понижении функции почек значительно замедляется. У людей пожилого возраста в результате уменьшения клубочковой фильтрации экскреция также может замедляться. Период полувыведения всех аминогликозидов у взрослых с нормальной функцией почек составляет 2-4 ч, у новорожденных - 5-8 ч, у детей - 2,5-4 ч. При почечной недостаточности период полувыведения может возрастать до 70 ч и более.
Показания :
1. Эмпирическая терапия (в большинстве случаев назначают в сочетании с в-лактамами, гликопептидами или антианаэробными препаратами, в зависимости от предполагаемых возбудителей):
Сепсис неясной этиологии.
Инфекционный эндокардит.
Посттравматические и послеоперационные менингиты.
Лихорадка у пациентов с нейтропенией.
Нозокомиальная пневмония (включая вентиляционную).
Пиелонефрит.
Интраабдоминальные инфекции.
Инфекции органов малого таза.
Диабетическая стопа.
Послеоперационные или посттравматические остеомиелиты.
Септический артрит.
Местная терапия:
Инфекции глаз - бактериальный конъюнктивит и кератит.
2. Специфическая терапия:
Чума (стрептомицин).
Туляремия (стрептомицин, гентамицин).
Бруцеллез (стрептомицин).
Туберкулез (стрептомицин, канамицин).
Антибиотикопрофилактика:
Деконтаминация кишечника перед плановыми операциями на толстой кишке (неомицин или канамицин в сочетании с эритромицином).
Аминогликозиды нельзя использовать для лечения внебольничной пневмонии как в амбулаторных, так и в стационарных условиях. Это связано с отсутствием активности этой группы антибиотиков в отношении основного возбудителя - пневмококка. При терапии нозокомиальной пневмонии аминогликозиды назначают парентерально. Эндотрахеальное введение аминогликозидов ввиду непредсказуемой фармакокинетики не приводит к повышению клинической эффективности.
Ошибочным является назначение аминогликозидов для терапии шигеллезов и сальмонеллезов (как внутрь, так и парентерально), поскольку они клинически неэффективны в отношении возбудителей, локализованных внутриклеточно.
Аминогликозиды не следует применять для лечения неосложненных инфекций МВП, за исключением случаев, когда возбудитель устойчив к другим, менее токсичным антибиотикам.
Аминогликозиды также не следует использовать для местного применения при лечении инфекций кожи ввиду быстрого формирования резистентности у микроорганизмов.
Необходимо избегать использования аминогликозидов для проточного дренирования и ирригации брюшной полости из-за их выраженной токсичности.
Правила дозирования аминогликозидов . У взрослых пациентов могут осуществляться два режима назначения аминогликозидов: традиционный , когда их вводят 2-3 раза в сутки (например, стрептомицин, канамицин и амикацин - 2 раза; гентамицин, тобрамицин и нетилмицин - 2-3 раза), и однократное введение всей суточной дозы .
Однократное введение всей суточной дозы аминогликозида позволяет оптимизировать терапию препаратами данной группы. Многочисленные клинические испытания показали, что эффективность лечения при однократном режиме назначения аминогликозидов такая же, как и при традиционном, а нефротоксичность выражена в меньшей степени. К тому же при однократном введении суточной дозы уменьшаются экономические затраты. Однако такой режим назначения аминогликозидов не должен использоваться при лечении инфекционного эндокардита.
На выбор дозы аминогликозидов оказывают влияние такие факторы, как масса тела пациента, локализация и тяжесть инфекции, функция почек.
При парентеральном введении дозы всех аминогликозидов должны рассчитываться на килограмм массы тела. Учитывая, что аминогликозиды плохо распределяются в жировой ткани, у пациентов с массой тела, превышающей идеальную более чем на 25%, должна быть проведена коррекция дозы. При этом рассчитанную на фактическую массу тела суточную дозу следует эмпирически снизить на 25%. В то же время у истощенных пациентов доза увеличивается на 25%.
При менингите, сепсисе, пневмонии и других тяжелых инфекциях назначают максимальные дозы аминогликозидов, при инфекциях МВП - минимальные или средние. Максимальные дозы не следует назначать людям пожилого возраста.
У пациентов с почечной недостаточностью дозы аминогликозидов обязательно должны понижаться. Это достигается либо уменьшением разовой дозы, либо увеличением интервалов между введениями.
Терапевтический лекарственный мониторинг. Поскольку фармакокинетика аминогликозидов нестабильна и зависит от целого ряда причин, для достижения максимального клинического эффекта при одновременном уменьшением риска развития НР проводят ТЛМ. При этом определяют пиковые и остаточные концентрации аминогликозидов в сыворотке крови. Пиковые концентрации (через 60 мин после в/м или через 15-30 мин после окончания в/в введения), от которых зависит эффективность терапии, при обычном режиме дозирования должны составлять для гентамицина, тобрамицина и нетилмицина не менее 6-10 мкг/мл, для канамицина и амикацина - не менее 20-30 мкг/мл. Остаточные концентрации (перед очередным введением), которые свидетельствуют о степени кумуляции аминогликозидов и позволяют контролировать безопасность терапии, для гентамицина, тобрамицина и нетилмицина должны быть менее 2 мкг/мл, для канамицина и амикацина - менее 10 мкг/мл. Проведение ТЛМ прежде всего необходимо у пациентов с тяжелыми инфекциями и при наличии других факторов риска токсического действия аминогликозидов. При назначении суточной дозы в виде однократного введения обычно контролируют остаточную концентрацию аминогликозидов.
Противопоказания : Аллергические реакции на аминогликозиды.
9. Левомицетины
Левомицетины - антибиотики с широким кругом действия. К группе левомицетинов относят Левомицетин и Синтомицин. Первый природный антибиотик-левомицетин было получено из культуры лучистого грибка Streptomyces venezualae в 1947 году, а в 1949-м установлено химическое строение. В СССР данный антибиотик получил название «левомицетин» в связи с тем, что является левовращающим изомером. В отношении бактерий не эффективен правовращающий изомер. Антибиотик данной группы, полученный синтетическим путем в 1950 году, был назван «Синтомицином». В состав синтомицина вошла смесь левовращающих и правовращающих изомеров, из-за чего и действие синтомицина слабее в 2 раза, по сравнению с левомицетином. Синтомицин применяется исключительно наружно.
Механизм действия . Левомицетиныхарактеризуются бактеристатическим действием, а конкретно нарушают синтез белка, фиксируются на рибосомах, что приводит к угнетению функции размножения микробных клеток. Это же свойство в костном мозге становится причиной остановки образования эритроцитов и лейкоцитов (может привести к анемии и лейкопении), а также угнетения кроветворения. У изомеров существует способность оказывать противоположное действие на ЦНС: левовращающий изомер угнетает центральную нервную систему, а правовращающий - умеренно ее возбуждает.
Круг активности . Антибиотики-левомицетины проявляют активность по отношению многих грамотрицательных и грамположительных бактерий; вирусов: Chlamydia psittaci, Сhlamydia trachomatis; Spirochaetales, Rickettsiae; штаммов бактерий, не поддающихся действию пенициллина, стрептомицина, сульфаниламидов. Незначительное действие оказывают на кислотоустойчивые бактерии (возбудителей туберкулеза, некоторых сапрофитов, проказы), Protozoa, Clostridium, Pseudomonas aeruginosa. Развитие лекарственной резистентности к антибиотикам данной группы проходит относительно медленно. Левомицетины не способны вызывать перекрестную устойчивость к другим химиотерапевтическим ЛС.
П оказания . Левомицетины используют при лечении трахомы, гонореи, различного вида пневмоний, менингита, коклюша, риккетсиозов, хламидиозов, туляремии, бруцеллеза, сальмонеллеза, дизентерии, паратифов, брюшного тифа и т.д.
10. Группа гликопептидов
К гликопептидам относятся природные антибиотики - ванкомицин и тейкопланин . Ванкомицин применяется в клинической практике с 1958 г., тейкопланин - с середины 80-х годов. В последнее время интерес к гликопептидам возрос в связи с увеличением частоты нозокомиальных инфекций , вызванных грамположительными микроорганизмами. В настоящее время гликопептиды являются препаратами выбора при инфекциях, вызванных MRSA , MRSE, а также энтерококками, резистентными к ампициллину и аминогликозидам .
Механизм действия . Гликопептиды нарушают синтез клеточной стенки бактерий. Оказывают бактерицидное действие, однако в отношении энтерококков, некоторых стрептококков иКНС действуют бактериостатически.
Спектр активности . Гликопептиды активны в отношении грамположительных аэробных и анаэробных микроорганизмов: стафилококков (включая MRSA , MRSE), стрептококков, пневмококков (включая АРП), энтерококков, пептострептококков, листерий, коринебактерий, клостридий (включая C.difficile ). Грамотрицательные микроорганизмы устойчивы к гликопептидам.
По спектру антимикробной активности ванкомицин и тейкопланин сходны, однако имеются некоторые различия в уровне природной активности и приобретенной резистентности. Тейкопланин in vitro более активен в отношении S.aureus (в том числе MRSA ), стрептококков (включая S.pneumoniae ) и энтерококков. Ванкомицин in vitro более активен в отношении КНС .
В последние годы в нескольких странах выделены S.aureus с пониженной чувствительностью к ванкомицину или к ванкомицину и тейкопланину.
Для энтерококков характерно более быстрое развитие резистентности к ванкомицину: в настоящее время в ОРИТ в США уровень резистентности E.faecium к ванкомицину составляет около 10% и более. При этом клинически важно, что некоторые VRE сохраняют чувствительность к тейкопланину.
Фармакокинетика . Гликопептиды практически не всасываются при приеме внутрь. Биодоступность тейкопланина при в/м введении составляет около 90%.
Гликопептиды не метаболизируются, выводятся почками в неизмененном виде, поэтому при почечной недостаточности требуется коррекция доз. Препараты не удаляются при гемодиализе.
Период полувыведения ванкомицина при нормальной функции почек составляет 6-8 ч, тейкопланина - от 40 ч до 70 ч. Длительный период полувыведения тейкопланина дает возможность назначать его один раз в сутки.
Показания :
1. Инфекции, вызванные MRSA , MRSE.
2. Стафилококковые инфекции при аллергии к в-лактамам.
3. Тяжелые инфекции, вызванные Enterococcus spp., C.jeikeium, B.cereus, F.meningosepticum .
4. Инфекционный эндокардит , вызванный зеленящими стрептококками и S.bovis , при аллергии к в-лактамам.
5. Инфекционный эндокардит , вызванный E.faecalis (в комбинации с гентамицином ).
6. Менингит , вызванный S.pneumoniae , резистентным к пенициллинам .
Эмпирическая терапия угрожающих жизни инфекций при подозрении на стафилококковую этиологию:
Инфекционный эндокардит трикуспидального клапана или протезированного клапана (в сочетании с гентамицином );
Подобные документы
Антибиотики из группы циклических полипептидов. Препараты группы пенициллинов, цефалоспоринов, макролидов, тетрациклинов, аминогликозидов и полимиксинов. Принципы комбинированного применения антибиотиков, осложнения, возникающие при лечении ими.
реферат , добавлен 08.04.2012
История открытия пенициллина. Классификация антибиотиков, их фармакологические, химиотерапевтические свойства. Технологический процесс получения антибиотиков. Устойчивость бактерий к антибиотикам. Механизм действия левомицетина, макролидов, тетрациклинов.
реферат , добавлен 24.04.2013
Классификация антибиотиков по механизму действия на клеточную стенку. Изучение ингибиторов функций цитоплазматической мембраны. Рассмотрение антимикробного спектра тетрациклинов. Тенденции развития резистентности микроорганизмов в настоящее время в мире.
реферат , добавлен 08.02.2012
История открытия антибиотиков. Механизм действия антибиотиков. Избирательное действие антибиотиков. Резистентность по отношению к антибиотикам. Основные группы известных на сегодняшний день антибиотиков. Основные побочные реакции на прием антибиотиков.
доклад , добавлен 03.11.2009
Изучение лекарственных препаратов под общим названием "антибиотики". Антибактериальные химиотерапевтические средства. История открытия антибиотиков, механизм их действия и классификация. Особенности применения антибиотиков и их побочные действия.
курсовая работа , добавлен 16.10.2014
Принципы рациональной антибиотикотерапии. Группы антибиотиков: пенициллины, тетрациклины, цефалоспорины, макролиды и фторхинолоны. Косвенное действие полусинтетических пенициллинов. Антимикробный спектр действия цефалоспоринов, основные осложнения.
презентация , добавлен 29.03.2015
Особенности использования антибактериальных средств для лечения и профилактики инфекционных заболеваний, вызванных бактериями. Классификация антибиотиков по спектру противомикробного действия. Описания отрицательных последствий применения антибиотиков.
презентация , добавлен 24.02.2013
Первооткрыватели антибиотиков. Распространение антибиотиков в природе. Роль антибиотиков в естественных микробиоценозах. Действие бактериостатических антибиотиков. Устойчивость бактерий к антибиотикам. Физические свойства антибиотиков, их классификация.
презентация , добавлен 18.03.2012
Классификация антибиотиков по спектру биологического действия. Свойства бета-лактамных антибиотиков. Бактериальные осложнения при ВИЧ-инфекции, их лечение. Природные соединения, обладающие высокой антибактериальной активностью и широким спектром действия.
реферат , добавлен 20.01.2010
Химические соединения биологического происхождения, оказывающие повреждающее или губительное действие на микроорганизмы в очень низких концентрациях по принципу антибиоза. Источники получения антибиотиков и направленность их фармакологического действия.






