Поражает ли амилоидоз позвоночник. Церебральный амилоидоз приводит к ранним когнитивным нарушениям. Амилоидоз кожных покровов
Кандидат медицинских наук В.Н. Кочегуров
АМИЛОИДОЗ ВНУТРЕННИХ ОРГАНОВ
В последние годы изменились многие представления об амилоидозе и методах его лечения. Под названием «амилоидоз» объединяется группа заболеваний, отличительным признаком которых является отложение в тканях особого гликопротеида, состоящего из фибриллярных или глобулярных белков, тесно связанных с полисахаридами, с нарушением структуры и функции пораженных органов.
Термин «амилоид» ввел в 1854 г. Р. Вирхов, который подробно изучил вещество, откладывающееся в тканях при так называемой сальной болезни у лиц, страдающих туберкулезом, сифилисом, актиномикозом, и счел его похожим на крахмал из-за характерной реакции с йодом. И только через 100 лет Кохеном с помощью электронной микроскопии была установлена его белковая природа.
Амилоидоз - достаточно распространенная патология, особенно если учесть существование его локальных форм, частота которых значительно увеличивается с возрастом.
Многообразие форм и вариантов амилоидоза не дает возможности систематизировать сведения об этиологии и патогенезе.
Современная классификация амилоидоза построена по принципу специфичности основного белка, образующего амилоид. По классификации ВОЗ (1993), вначале приводится тип амилоида, затем указывается белок-предшественник и уже потом - клинические формы заболевания с перечислением преимущественных органов-мишеней. Во всех названиях типов амилоида первой буквой является «А», означающая «амилоид», далее за ней следует аббревиатура конкретного фибриллярного белка, из которого он образовался:
АА-амилоидоз . Второе «А» - это обозначение острофазового белка (SSA--глобулин), продуцируемого в ответ на воспаление или наличие опухоли (an acute-phase protein);
AL -амилоидоз. «L» - это легкие цепи иммуноглобулинов (light chains);
ATTR -амилоидоз. «TTR» - это транстиретин, транспортный белок для ретинола и тироксина;
A 2 М-амилоидоз. « 2 М» - это 2 -микроглобулин (диализный амилоидоз).
АА-амилоидоз. АА-амилоид образуется из сывороточного острофазового белка, представляющего собой -глобулин, который синтезируется гепатоцитами, нейтрофилами и фибробластами. Его количество повышается многократно при воспалении или наличии опухолей. Однако участвуют в образовании амилоида лишь отдельные его фракции, поэтому амилоидоз развивается лишь у части пациентов с воспалительными или опухолевыми заболеваниями. Конечный этап амилоидогенеза – полимеризация растворимого предшественника в фибриллы – до конца не выяснен. Считается, что этот процесс происходит на поверхности макрофагов при участии мембранных ферментов и тканевых факторов, что и определяет органное поражение.
АА-амилоидоз объединяет 3 формы:
Вторичный реактивный амилоидоз при воспалительных и опухолевых заболеваниях. Это самая распространенная форма. В последние годы среди причин вторичного амилоидоза на первый план вышли ревматоидный артрит, болезнь Бехтерева, псориатический артрит и опухоли, в т.ч. системы крови (лимфома, лимфогранулематоз), а также неспецифический язвенный колит и болезнь Крона. В то же время хронические гнойно-обструктивные заболевания легких отступают на второй план, так же как туберкулез и остеомиелит.
Периодическая болезнь (семейная средиземноморская лихорадка) с аутосомно-рецессивной формой наследования. Отмечается этническая предрасположенность к ней у арабов, армян, евреев и цыган. Выделяют 4 формы этого заболевания: лихорадочную, суставную, торакальную и абдоминальную. На первом-втором десятилетиях жизни у больных возникают немотивированная лихорадка или проявления артрита. Дебют болезни возможен с развития клиники сухого плеврита или картины «острого» живота. Причем эти эпизоды обычно кратковременные, длительностью 7-10 дней, стереотипны по своим проявлениям и длительное время не вызывают осложнений (деформаций и дефигураций суставов, спаек или шварт плевральных листков, спаечной болезни брюшной полости). Однако у 40% больных на втором-третьем десятилетиях жизни развивается прогрессирующий амилоидоз почек.
Синдром Макла-Уэльса или семейная нефропатия с крапивницей и глухотой, наследуемый по аутосомно-доминантному типу. В первые годы жизни у больных периодически возникают аллергические сыпи, чаще в виде крапивницы или отека Квинке, сопровождающиеся лихорадкой, лимфаденопатией, артро- и миалгиями, болями в животе, эозинофильными инфильтратами в легких. Эти симптомы спонтанно исчезают через 2-7 суток с последующей ремиссией. Параллельно возникает и прогрессирует снижение слуха, а на втором-третьем десятилетиях жизни присоединяется амилоидоз почек. Это наиболее распространенный вариант наследственного амилоидоза.
Органами-мишенями при АА-амилоидозе чаще всего бывают почки, а также печень, селезенка, кишечник и надпочечники.
А L -амилоидоз . АL-амилоид образуется из легких цепей иммуноглобулинов, в которых изменена последовательность аминокислот, вызывающая дестабилизацию этих молекул и способствующая образованию фибрилл амилоида. В этом процессе участвуют местные факторы, особенности которых определяют поражение тех или иных органов. Иммуноглобулины синтезируются аномальным клоном плазматических или В-клеток в костном мозге, появившихся, по-видимому, в результате мутации или Т-иммунодефицита и снижения контролирующей функции последних.
АL-амилоидоз включает в себя 2 формы:
1) Первичный идиопатический амилоидоз , при котором нет предшествующего заболевания;
2) Амилоидоз при миеломной болезни и В-клеточных опухолях (болезнь Вальденстрема, Франклина и др.). АL-амилоидоз сейчас рассматривают в рамках единой В-лимфоцитарной дискразии.
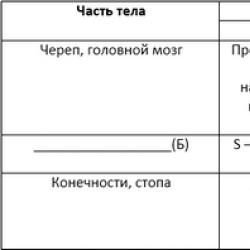
К основным органам-мишеням при АL-амилоидозе относятся сердце, желудочно-кишечный тракт, а также почки, нервная система, кожа. Дефицит Х фактора свертывания крови при АL-амилоидозе считают причиной развития геморрагического синдрома с характерными кровоизлияниями вокруг глаз («глаза енота»).
В дифференциальной диагностике системного амилоидоза следует принимать во внимание то, что АА-тип более «молодой», средний возраст заболевших составляет менее 40 лет, а при АL-амилоидозе - 65 лет, причем при обоих типах отмечается преобладание мужчин (1,8-1).
ATTR -амилоидоз включает в себя 2 варианта:
Семейная нейропатия (реже кардио- и нефропатия) с аутосомно-доминантным типом наследования. При этом ATTR-амилоид образуется из мутантного транстиретина, синтезируемого гепатоцитами. Мутантные белки нестабильны и при определенных условиях преципитируют в фибриллярные структуры, образуя амилоид.
Системный старческий амилоидоз , развивающийся исключительно у пожилых людей (старше 70 лет). В его основе лежит нормальный по аминокислотному составу транстиретин (т.е. не мутантный), но с измененными физико-химическими свойствами. Они связаны с возрастными метаболическими сдвигами в организме и обусловливают образование фибриллярных структур.
Для этого варианта характерно поражение нервной системы, реже почек и сердца.
A 2 М-амилоидоз – это относительно новая форма системного амилоидоза, появившаяся в связи с внедрением в практику хронического гемодиализа. Белком-предшественником является 2 -микроглобулин, который не фильтруется при гемодиализе через большинство мембран и задерживается в организме. Его уровень повышается в 20-70 раз, что служит основой для развития амилоидоза в среднем через 7 лет от начала гемодиализа.
Основными органами-мишенями являются кости и периартикулярные ткани. Могут возникнуть патологические переломы костей. В 20% случаев наблюдается синдром карпального канала (онемение и боль в первых трех пальцах кисти, распространяющиеся на предплечье с последующим развитием атрофии мышц тенара из-за сдавления срединного нерва отложениями амилоидных масс в области карпальной связки).
Кроме системных форм выделяют локальный амилоидоз , который возникает в любом возрасте, но чаще в пожилом, и поражает любую ткань или орган. Практическое значение имеет амилоидоз островков поджелудочной железы у стариков (ААIАРР-амилоид). Сейчас накоплено достаточно фактов, свидетельствующих о том, что почти все случаи диабета 2 типа у людей пожилого возраста патогенетически связаны с амилоидозом островкового аппарата поджелудочной железы, который образуется из полипептида -клеток.
Церебральный амилоидоз (АВ-амилоид) рассматривают как основу церебральной деменции Альцгеймера. При этом сывороточный -протеин откладывается в старческих бляшках, мозговых нейрофибриллах, сосудах и оболочках.
Среди всех типов амилоидоза наибольшее значение имеют АА- и АL-формы системного амилоидоза.
Амилоидоз почек. Наиболее часто поражаемым органом при системном амилоидозе являются почки. Сначала амилоид откладывается в мезангиуме, потом вдоль базальной мембраны клубочков, пенетрируя в нее и вскрывая подэпителиальное пространство и камеру Шумлянского-Боумена. Затем амилоид откладывается в стенках сосудов, строме пирамид, капсуле почек.
Первым клиническим проявлением амилоидоза почек является протеинурия , которая зависит не столько от величины отложений амилоида, сколько от деструкции клеток-подоцитов и их ножек. Сначала она носит транзиторный характер, иногда сочетается с гематурией или/и лейкоцитурией. Это латентная стадия нефропатического варианта амилоидоза. С момента стабилизации протеинурии наступает вторая – протеинурическая стадия. По мере увеличения протеинурии и формирования гипопротеинемии с развитием вторичного альдостеронизма и возникновением нефротических отеков наступает третья – нефротическая стадия . При снижении функций почек и появлении азотемии наступает четвертая – азотемическая стадия поражения почек.
В «классических» случаях у больных амилоидозом почек формируется нефротический синдром (НС) с его отечным периодом, причем время развития НС индивидуально. Важно отметить, что артериальная гипертензия не является характерным признаком , так как происходит поражение ЮГА со снижением продукции ренина, и она может возникнуть лишь у 10-20% больных при далеко зашедшей ХПН.
Примечательно, что при амилоидозе размеры почек сохраняются неизмененными или даже увеличиваются («большие сальные почки» ), несмотря на нарастание их функциональной неполноценности. Выявление этого симптома с помощью УЗ–сканирования и рентгенологического метода является важным диагностическим критерием амилоидного поражения почек.
Сердце при амилоидозепоражается часто, особенно при АL-варианте. В результате отложения амилоида в миокарде нарастает ригидность сердечной стенки, страдает функция диастолического расслабления.
Клинически это проявляется кардиомегалией (вплоть до развития «бычьего сердца»), глухостью тонов, прогрессирующей рефрактерной к лечению сердечной недостаточностью , которая является причиной смерти у 40% больных. У части больных развивается инфаркт миокарда вследствие отложений амилоида в коронарных сосудах, стенозирующих их просвет. Возможно вовлечение клапанов сердца с развитием того или иного порока сердца и поражения перикарда, напоминающего констриктивный перикардит.
На ЭКГ регистрируется снижение вольтажа зубцов, при эхокардиографии отмечается симметричное утолщение стенок желудочков с признаками диастолической дисфункции. В зависимости от локализации депозитов амилоида в миокарде может наблюдаться синдром слабости синусового узла, АВ-блокада, разнообразные аритмии, иногда очаговые поражения с инфарктоподобной картиной на ЭКГ.
Желудочно-кишечный тракт при амилоидозепоражается на всем протяжении. Макроглоссия, встречающаяся у 22% больных с амилоидозом, является патогномоничным симптомом . При этом развивается дисфагия, дизартрия, глоссит, стоматит , а по ночам не исключена асфиксия вследствие западения языка и перекрытия им дыхательных путей.
Отложение амилоида в пищеводе сопровождается нарушениями его функций, иногда находят опухолевидные образования в желудке и кишечнике . Нередко поражается мышечный слой кишечника и нервные сплетения, что приводит к нарушению моторики ЖКТ, вплоть до возникновения илеуса . Отложение амилоида в тонком кишечнике приводит к появлению синдромов мальабсорбции и мальдигестии . Вследствие поражения сосудов образуются язвы кишечника с развитием кровотечений, что симулирует картину опухолей или неспецифического язвенного колита.
Отложение амилоида в поджелудочной железе приводит к ее внешне- и внутрисекреторной недостаточности.
С большой частотой вовлекается в процесс печень (у 50% больных АА-амилоидозом и у 80% - АL-амилоидозом). Характерно длительное сохранение функций печени с отсутствием синдромов цитолиза и холестаза . В развернутой стадии появляются признаки портальной гипертензии с кровотечениями из варикозно расширенных вен. Типична желтуха за счет сдавления желчных капилляров. Часто определяется спленомегалия с явлениями гиперспленизма , а также увеличение периферических лимфоузлов .
Дыхательная система чаще всего вовлекается в процесс при АL-амилоидозе (у 50% больных), реже - при АА-амилоидозе (10-14%).
К ранним признакам относится осиплость голоса , связанная с отложением амилоида в голосовых связках. Затем присоединяется поражение бронхов, альвеолярных перегородок, сосудов. Возникают ателектазы и инфильтраты легких, диффузные изменения по типу фиброзирующего альвеолита с дыхательной недостаточностью и легочной гипертензией, способствующие формированию хронического легочного сердца . Возможны легочные кровотечения или развитие локального легочного амилоидоза, имитирующего картину рака легкого.
Вовлечение периферической и вегетативной нервной системы отмечается при системном амилоидозе разных типов, но в большей степени при АL- и АТТR-типах. Периферическая сенсорная, иногда моторная нейропатия (как правило, симметричная, начинающаяся с дистальных отделов конечностей и распространяющаяся на проксимальные) может преобладать в клинической картине, создавая диагностические трудности. Нарушения вегетативной нервной системы могут быть значительно выражены и проявляются симптомами ортостатической гипотонии, импотенцией, сфинктерными расстройствами.
Центральная нервная система при амилоидозе поражается редко.
Среди поражений других органов следует отметить возможность поражения надпочечников и щитовидной железы с развитием симптомов их недостаточности.
Амилоидные отложения в коже могут иметь вид папул, узлов, бляшек, диффузной ее инфильтрации с трофическими изменениями, приобретенного тотального альбинизма.
Вовлечение в процесс суставов и периартикулярных тканей , как уже упоминалось, связано с диализным амилоидозом.
Поражение скелетных мышц обычно резко снижает качество жизни больных. Сначала отмечается псевдогипертрофия мышц с последующей их атрофией, приводящей к обездвиживанию больного.
Изменение лабораторных показателей при амилоидозе неспецифично: увеличение СОЭ, гиперглобулинемия, тромбоцитоз, который наряду с малыми размерами тромбоцитов и появлением эритроцитов с тельцами Жолли рассматривают как свидетельство гиперспленизма .
Диагностика амилоидоза, предполагаемого по клиническим признакам, должна быть подтверждена обнаружением субстрата патологии, а именно, амилоида.
С этой целью можно использовать красочные пробы . В одной из модификаций больному внутривенно вводят краситель (синька Эванса, конго-красный ), который может захватываться амилоидными массами, что приводит к снижению его концентрации в крови.
В другом варианте исследования больному подкожно в подлопаточную область вводят 1 см 3 1% свежеприготовленного раствора метиленового синего и затем следят за изменением цвета мочи. Если амилоидные массы захватили краситель, цвет мочи не изменяется, и проба считается положительной, что подтверждает диагноз амилоидоза. Если проба отрицательная (цвет мочи изменен), то это не исключает наличие амилоидоза.
Другим методом диагностики является биопсия. Если производится биопсия пораженного органа (почки, печени и др.), то частота положительных результатов достигает 90-100%. Чем выше степень инфильтрации органов-мишеней амилоидом, тем больше возможность его обнаружения. Обычно диагностику амилоида начинают с биоптатов слизистой оболочки полости рта с подслизистым слоем в области десны около 3-4 моляра или в прямой кишке. При АL-амилоидозе рекомендуют в первую очередь проводить биопсию костного мозга или аспирационную биопсию подкожно-жировой клетчатки передней брюшной стенки (чувствительность около 50%). При диализном амилоидозе целесообразна биопсия периартикулярных тканей.
В последние годы все шире применяется сцинтиграфия с меченым I 123 сывороточным Р-компонентом для оценке in vivo распределения амилоида в организме. Метод особенно полезен для контроля динамики его тканевых отложений в процессе лечения. Важно не только обнаружить амилоид в тканях, но и провести его типирование с помощью красочных методов или, что более точно, с помощью антисывороток (поли- и моноклональные антитела) к основным белкам амилоидных фибрилл.
Лечение амилоидоза должно быть направлено на уменьшение синтеза и доставки белков-предшественников, из которых строится амилоид.
При лечении АА-амилоидоза , его вторичного варианта, необходимым условием является терапия заболевания, приведшего к развитию амилоидоза всеми доступными методами (антибиотики, химиопрепараты, хирургическое вмешательство).
Препаратами выбора являются 4-аминохинолиновые производные (делагил, плаквенил, резохин, хингамин и др.). Они тормозят синтез амилоидных фибрилл на ранних стадиях амилоидогенеза, ингибируя ряд ферментов. Делагил назначают по 0,25 г длительно (годами).
Белковые фибриллы, образующие амилоид, содержат большое количество свободных сульфгидрильных групп (SH), которые активно участвуют в агрегации белков в стабильные структуры. С целью их блокады применяют унитиол по 3-5 мл 5% раствора внутримышечно ежедневно с постепенным увеличением дозы до 10 мл в сутки в течение 30-40 дней и повторными курсами 2-3 раза в год.
По-прежнему рекомендуется прием сырой или кулинарно обработанной печени по 100-150 г в сутки в течение 6-12 месяцев. Белки и антиоксиданты печени тормозят развитие амилоидоза. Можно использовать также печеночные гидролизаты , в частности сирепар (2 мл сирепара соответствуют 40 г печени), и проводить лечение, чередуя прием сырой печени в течение 1-2 месяцев с 2-3 месячным применением сирепара (внутримышечно по 5 мл 2 раза в неделю).
Применяют иммуномодуляторы: левамизол (декарис) по 150 мг 1 раз в 3 дня (2-3 недели), тималин по 10-20 мг внутримышечно 1 раз в день (5 дней), Т-активин по 100 мкг внутримышечно 1 раз в день (5 дней).
Признается положительный эффект димексида , оказывающего прямое рассасывающее действие. Его применяют перорально в виде 10-20% раствора в суточной дозе не менее 10 г в течение 6 месяцев.
При периодической болезни показан колхицин , обладающий антимитотическим действием. Препарат замедляет амилоидогенез. Его раннее назначение может предупредить возникновение амилоидоза почек, что является наиболее опасным при данной патологии. Назначают длительно (пожизненно) в дозе 1,8-2 мг в сутки (таб. 2 мг).
Лечение А L -амилоидоза . Поскольку этот тип амилоидоза рассматривают в рамках моноклональной пролиферации плазматических или В-клеток, то в лечении применяют различные схемы полихимиотерапии с целью уменьшить продукцию предшественников – легких цепей иммуноглобулинов. Чаще всего используют схему цитостатик мелфолан+преднизолон (мелфолан в дозе 0,15 мг/кг, преднизолон по 0,8 мг/кг по 7 дней каждые 4-6 недель в течение 2-3 лет). Сейчас применяют и более агрессивные схемы с включением винкристина, доксорубицина, циклофосфана.
Существует мнение о целесообразности применения левамизола или других иммуномодуляторов для повышения функции Т-супрессоров.
В лечении АТТ R -амилоидоза наиболее эффективна трансплантация печени .
Для лечения A 2 М- илидиализного амилоидоза применяют высокопоточный гемодиализ с гемофильтрацией и иммуносорбцией. Благодаря этому снижается уровень 2 -микроглобулина. При необходимости производят трансплантацию почек .
Следует отметить, что проведение адекватного лечения часто оказывается невозможным из-за позднего распознавания болезни с вовлечением в патологический процесс многих органов. Поэтому решающее значение имеет ранняя диагностика, основанная на знании разнообразных проявлений амилоидоза.
Профилактика. Основной профилактики вторичного амилоидоза является успешное лечение гнойно-воспалительных, системных и опухолевых заболеваний. В случаях идиопатического амилоидоза проблема профилактики должна решаться путем тщательного сбора анамнеза семейно-наследственных заболеваний и медико-генетического консультирования.
Амилоидоз — это заболевание, характеризующееся системным поражением паренхиматозных органов (щитовидной железы, легких, и почек селезенки, печени). Итогом неправильного формирования и избыточного накопления в межклеточном пространстве сложного низкомолекулярного, нерастворимого белка, или так называемого белково-полисахаридного комплекса, служит склероз и атрофии в тканях, и как следствие приводит к недостаточности органов.
Данная патология относительно молодая и была выявлена немецким ученым Шлейденом М.Я. в 1983 г., который доказал участие грубодисперсных белков в образовании амилоида.
Этиология
Причиной амилоидоза подтипа АА (где А — амилоид; А — миелоидный протеин) служит длительно текущие заболевания в хронической стадии: бронхоэктатическая болезнь, туберкулез, ревматоидный артрит, анкилозирующий спондилоартрит, остеомиелит. В группу риска попадают лица старше 40 лет, но и диагностирование в детском возрасте является не исключением.
Диагностика и локализация
ВАЖНО!Своевременная диагностика амилоидоза затруднительна. Диагноз подтверждается только при взятии биопсийного материала и по результатам гистологического исследования. Поэтому важно обращать внимание на детали анамнеза, а так же подробно описать течение и последовательность проявлений.
Характерной локализацией для амилоидоза являются почки и в 85% печень, признаком, которого могут быть увеличение в размерах селезенки и печени, без развития цирроза у последнего.
Клиническое течение и основные ее проявления
В развитии вторичного амилоидоза выделяют четыре стадии:
- скрытое течение — заболевание практически не распознается. Выявляются незначительные изменения в анализах мочи в виде увеличения количества лейкоцитов и уменьшения ее плотности.
- протеинурическая стадия — длительность этой стадии составляет от 2 до 8 лет. Характеризуется увеличением белка в моче до 2-4 г/л. Частота возникновения в 70% случаев.
- нефротическая стадия — продолжительность формирования от 1 года до 3-5 лет. Начинают развиваться необратимые изменения. Клиническая картина отражается в появлении отеков, нарастании нарушения белкового обмена, гиперхолестеринемии.
- терминальная стадия — и как следствие тяжелая почечная недостаточность с возможным летальным исходом.
Лечение и прогноз для жизни

К сожалению, действительно эффективного метода лечения на сегодняшний день не существует. Прогноз для жизни остается сомнительный, т.к. летальность и инвалидизация от амилоидоза высока.
Консервативная терапия строится на трех основных постулатах:
- подавление первичного фактора, что значительно замедляет прогрессирующее развитие заболевания.
- угнетение синтеза грубодисперсного белка. Наиболее зарекомендовавшим себя препаратом считается Колхицин.
- симптоматическая терапия.
ВНИМАНИЕ: не занимайтесь самолечением и самодиагностикой. Своевременное обращение и соблюдение рекомендаций специалистов позволяет во вовремя диагностировать патологию, уменьшая риск развития инвалидности и летального исхода.
Полезное видео — амилоидоз, чем он опасен и как с ним бороться
Амилоидоз - это системное заболевание, характеризующееся отложением в тканях амилоида (сложного белково-полисахаридного комплекса).
Амилоидоз приводит к атрофии, склерозу и недостаточности различных органов.
Частота встречаемости - не менее 1:50 000 (в основном возникает после 60 лет).
Классификация
1. Первичный амилоидоз обусловлен изменениями клеток при миеломной болезни , моноклональной гипергаммаглобулинемии, макроглобулинемии Вальденстрема.
Амилоид состоит из легких цепей иммуноглобулинов, их синтез резко увеличен при указанных заболеваниях.
2. Вторичный амилоидоз возникает вследствие хронических воспалительных заболеваний (например, при ревматоидном артрите , остеомиелите, бронхоэктатической болезни , малярии , туберкулезе, лепре).
Амилоид состоит из фибриллярного белка амилоида и продуктов его распада - сывороточного амилоидного белка.
3. Семейный (идиопатический) амилоидоз. Обычно - врожденный дефект ферментов. Имеется несколько форм врожденного амилоидоза, например при средиземноморской лихорадке (семейный пароксизмальный полисерозит - заболевание неясной причины, проявляющееся болями в животе, приступами лихорадки, плевритом , артритом и высыпаниями на коже).
4. Старческий амилоидоз.
5. Диализный амилоидоз развивается при проведении гемодиализа.
Причины
Причины преимущественного поражения тех или иных органов (почек, кишечника, кожи) неизвестны.
Признаки и течение заболевания разнообразны и зависят от локализации амилоидных отложений, степени их распространенности в органах, длительности заболевания, наличия осложнений.
Чаще наблюдают комплекс симптомов, связанных с поражением нескольких органов.
Проявления амилоидоза:
*желудочно-кишечного тракта
- Увеличение размеров языка
- Нарушение глотания
- Опухолевидные отложения амилоида в желудке или кишечнике (не часто)
Амилоидоз пищевода обычно сопровождается поражением других отделов пищеварительной системы. Характерны затруднение глотания при проглатывании плотной и сухой пищи, отрыжка.
Амилоидоз желудка обычно сочетается с амилоидозом кишечника и других органов. Проявления: ощущение тяжести в подложечной области после еды, изжога, отрыжка, тошнота.
Амилоидоз кишечника возникает часто, проявляется ощущением дискомфорта, тяжести, реже умеренными болями в животе, нарушениями стула (запорами или упорной диареей). Изолированный опухолевидный амилоидоз кишечника протекает под маской опухоли (боль, непроходимость кишечника), и обычно его выявляют во время операции.
Амилоидоз печени наблюдают сравнительно часто, характерны увеличение и уплотнение печени, нередко появляются синдром портальной гипертензии , реже возникают боли в правом подреберье, тошнота, отрыжка, желтуха , кровоизлияния.
Амилоидоз поджелудочной железы обычно протекает под маской хронического панкреатита ; характерны тупая боль в левом подреберье, отрыжка, тошнота, рвота.
*сердца
- Устойчивая к лечению застойная сердечная недостаточность
- Нарушения ритма и проводимости
- Очаговые поражения миокарда (псевдоинфаркт).
*нервной системы
- Периферическая полиневропатия (ощущение жжения, покалывания, «мурашек» в конечностях, нарушение чувствительности)
- Нарушения вегетативной нервной системы (головные боли, голокружение, потливость)
- Ортостатическая гипотензия
- Импотенция
- Сфинктерные расстройства (недержание мочи, кала).
*сухожилий, хрящей
- Синдром запястного канала (онемение, покалывание и пульсирующая боль в пальцах)
- Симметричный полиартрит, плечелопаточный периартрит, плотный отек околосуставных.
*тканей
- Увеличение селезенки.
*органов дыхания
- Охриплость голоса
- Бронхит
- Опухолевидный легочный амилоидоз.
Поражения кожи - папулы, бляшки, узлы, кровоизлияния вокруг глаз («симптом очков»).
- Вовлечение щитовидной железы со снижением ее функции.
- Вовлечение надпочечников с их недостаточностью.
- Амилоидоз почечный, типичен для всех форм амилоидоза.
Диагностика
- В крови анемия, лейкоцитоз, повышение СОЭ, почти в 80 % случаев в начале заболевания возникают снижение количества белков, гиперглобулинемия, снижение уровня тромбоцитов , натрия, кальция.
- При поражении печени - повышение уровня холестерина , в ряде случаев - билирубина , повышение активности щелочной фосфатазы
- Оценка функций щитовидной железы - возможно снижение функций щитовидной железы
- Оценка функций почек - почти в 50 % случаев амилоидоз начинается с почечной недостаточности. При исследовании мочи, помимо белка , в осадке обнаруживают цилиндры, эритроциты , лейкоциты
- При первичном амилоидозе в плазме крови и/или моче обнаруживают увеличение содержания амилоида
- При вторичном амилоидозе следует обратить внимание на лабораторные признаки хронических воспалительных заболеваний
- В кале - большое количество жира, крахмала, мышечных волокон
Диагностические мероприятия
- Эхокардиография (при подозрении на поражение сердца)
- Рентгенологическое исследование
- Функциональные клинические пробы с конго красным и метиленовым синим (быстрое исчезновение красителей при внутривенном введении из сыворотки крови вследствие их
- фиксации амилоидом и значительное снижение выделения их почками). При первичном амилоидозе эти пробы не всегда информативны
- Биопсия органов - наиболее информативный метод.
Лечение амилоидоза
Общие принципы терапии
Режим домашний, за исключением тяжелых состояний (выраженная сердечная недостаточность, хроническая почечная недостаточность)
При первичном амилоидозе в начальных стадиях процесса - хлорохин 0,25 г 1 р./сут. длительно, сочетание мелфалана и преднизолона, мелфалана, преднизолона и колхицина или только колхицин
При вторичном амилоидозе - лечение основного заболевания (туберкулез, остеомиелит , эмпиема плевры и др.), после излечения которого нередко исчезают и проявления амилоидоза
Перевод пациента с диализным амилоидозом на перитонеальный диализ
При амилоидозе кишечника, протекающем с упорной диареей, - вяжущие средства (висмута субнитрат, адсорбенты)
При вторичном амилоидозе - специфическое лечение основного заболевания
При семейном амилоидозе - колхицин (по 0,6 мг 2-3 р./сут.)
Симптоматическая терапия: витамины, диуретические средства, препараты, снижающие давление, переливание плазмы и т. д.
Больным амилоидозом показан длительный (1,5-2 года) прием сырой печени (по 100-120 г/сут.)
Ограничение потребления белка, соли пациентам с хронической почечной недостаточностью
Ограничение соли для пациентов с сердечной недостаточностью
Хирургическое лечение амилоидоза
Удаление селезенки может улучшить состояние вследствие уменьшения количества амилоида, образующегося в организме.
Прогноз
Прогноз при амилоидозе определяется основным заболеванием. Средняя выживаемость - 12-14 месяцев. Женщины часто живут дольше. Заболевание протекает тяжелее у лиц пожилого возраста.
Амилоидоз - это недуг, который может поражать все органы в организме. Основная причина его развития – скопление в тканях белка амилоида, которого в норме в организме быть не должно. Как правило, данное нарушение выработки белка поражает организм людей от 60 лет и старше. Самое опасное состоит в том, что АА и А1 амилоидоз может стать «катализатором» для таких заболеваний, как склероз, недостаточность внутренних органов и даже атрофии конечностей.
Причины
А1 амилоидоз (первичный) и АА амилоидоз (вторичный) может возникнуть на фоне следующих заболеваний:
- воспалительные процессы;
- болезни, которые не свойственные определённому климату;
- инфекционные заболевания ();
- все патологии, которые поражают костный мозг;
- хронические болезни суставов.
Стоит отметить и тот факт, что клетки амилоида могут подвергаться мутации в крови. Как следствие, данное нарушение может носить наследственный характер. Клетки амилоида не распадаются даже после смерти человека длительное время. Процесс может возникнуть в любом внутреннем органе.
Виды
Подтип А1 амилоидоз (первичный)
При первичной форме недуга в клетках тканей внутренних органов откладывается парапротеин. Это лёгкие цепи иммуноглобулинов. Этот процесс является необратимым и ведёт к неминуемому поражению внутренних органов. Как следствие, значительно снижается продолжительность жизни пациента.
Симптоматика зависит от того, какие именно органы поражены. Как правило, наблюдается следующее:
- слабость;
- быстрая утомляемость;
- увеличение лимфоузлов;
- нарушение в работе ЖКТ, сердца.
Окончательный диагноз можно поставить только после нескольких лабораторных и инструментальных исследований.
Подтип АА амилоидоз
Для данного подтипа характерно накопление в тканях сывороточных острофазных соединений белков. В отличие от формы AL, AA амилоидоз образуется вследствие перенесённых воспалительных процессов. В группу риска подпадают чаще всего мужчины от 40 лет. Что касается женщин, то их данная патология поражает гораздо реже.
При данной форме заболевания больше всего поражаются почки. У 10% процентов пациентов может наблюдаться нарушение в работе селезёнки и печени. И лишь у 3% возможны проблемы с сердцем. Обнаружить последнее можно только при проведении специального исследования - эхокардиографии. Практически всегда у трети пациентов через 5 лет начинает прогрессировать почечная недостаточность.
Общая клиническая картина
Как уже было сказано, патология может коснуться практически каждого внутреннего органа. Поэтому точного перечня симптомов на сегодня медицина выдать не может. Так как лечению А1 амилоидоз, так же как и тип АА амилоидоз полностью не поддаётся, терапия направлена на замедление развития патологического процесса в организме человека. Диагностика недуга должна проводиться исключительно специалистами, так как точный диагноз ставится на основе данных, полученных при помощи лабораторных анализов и инструментальных методов обследования. Помимо внутренних органов, А1 и АА амилоидоз может поражать даже участки кожного покрова человека.
Амилоидоз кожных покровов
Амилоидоз кожи проявляется в виде образования кровяных отёков вокруг глаз. В народе его часто называют как «эффект очков». Помимо этого, на коже можно наблюдать образование узлов, бляшек и папул. Такие образования чаще всего локализуются в области лобка, бёдер, подмышек. Кожные покровы в поражённой области могут быть бледными или с кровяным оттенком. На лице эти патологии практически никогда не наблюдаются, только при острой запущенной форме и ослабленной иммунной системе.
Различают три этапа течения болезни:
- первичный системный;
- местный лихеноидный;
- вторичный системный.
Симптоматика
Первичный системный амилоидоз встречается чаще всего у людей пожилого возраста. Симптомы заболевания выражены. Может набрякать язык, увеличиваться в объёмах в 3–4 раза. Ухудшается и общее состояние больного - наблюдается нестабильная температура, слабость, болевые ощущения в мышцах. Узелки могут группироваться, однако зуда или шелушения не наблюдается. Амилоидоз кожи на этой стадии может дополняться другими заболеваниями. Чаще всего это проблемы с почками.
Местный лихеноидный системный амилоидоз кожи напоминает или . Узелки могут располагаться так же, как и при первичной форме, однако наблюдается обильное шелушение. В некоторых случаях пациенты высказывают жалобы на сильный зуд.
Вторичный амилоидоз кожи, как правило, образуется вследствие другого кожного заболевания или ослабленной иммунной системы на фоне других хронических или воспалительных процессов. Дополнительные симптомы зависят уже от состояния здоровья пациента.
Амилоидоз кожи лечится несколько проще, чем амилоидоз почек или печени. В план лечения обязательно входит курс витаминов. Если наблюдается сильный зуд, то больному могут назначить специальные антисептики. Наиболее оптимистические прогнозы можно делать в том случае, если диагностируется местный тип патологии. В любом случае даже по окончании лечения длительное время нужно регулярно посещать дерматолога. Возможен рецидив заболевания.
Амилоидоз почек
Развитие данного недуга может произойти на фоне уже имеющихся хронических заболеваний в организме. Но также он может развиться и самостоятельно. Именно этот тип патологии считается клиницистами наиболее опасным. Практически во всех клинических случаях пациенты нуждаются в гемодиализе или трансплантации органа. К сожалению, в последние годы болезнь прогрессирует. Возможен и вторичный амилоидоз почек. Последнее возникает на фоне перенесённых острых воспалительных процессов, хронических заболеваний и острых инфекций. Наиболее часто амилоидоз почек встречается, если пациент болеет туберкулёзом лёгких.
Классификация патологии
В современной медицине применяют классификацию Серова. Согласно ей болезнь классифицируют так:
- идиопатический или первичный;
- наследственный;
- приобретённый;
- старческий;
- локальный.
Точного перечня симптомов нет. В этом случае применима общая симптоматика для первичной диагностики:
- недомогание;
- перепады температуры тела;
- отеки под глазами;
- снижение веса и перепады настроения.
К сожалению, амилоидоз почек практически не лечится. При правильных клинических мероприятиях возможно только поддержание жизнедеятельности больного.
Амилоидоз печени
Амилоидоз печени наблюдается довольно часто. Для этой формы патологии характерно увеличение и уплотнение печени. При этом при надавливании никаких болезненных ощущений не возникает. Довольно часто симптомы могут быть схожи с асцитом.
На начальной стадии амилоидоз печени проявляется в виде боли в правом подреберье и . На этом этапе возможно общее недомогание и слабая тошнота. Ввиду этого, данное состояние пациент часто путает с пищевым отравлением и не обращается к врачу. Довольно часто начальный амилоидоз печени переходит в хронический.
Эта форма заболевания наиболее сложная из всех вышеперечисленных в плане диагностики. Амилоидоз сердца можно обнаружить только при проведении специального клинического исследования - эхокардиографии (ЭКГ).
Симптоматика:
- нарушение ритма (аритмия);
- устойчивая к лечению ;
- псевдоинфаркт.
Если лечение не начать своевременно, то в 95 процентах наблюдается летальный исход. Поэтому при первых симптомах следует незамедлительно обращаться к врачу.

Амилоидоз кишечника и селезёнки
В более редких случаях недуг поражает кишечник и селезёнку. Нарушения белковых процессов в работе кишечника диагностировать намного сложнее, чем AL амилоидоз почек или печени. Симптомы недуга практически идентичны пищевому отравлению:
- тяжесть после приёма пищи;
- нарушение стула;
- общее недомогание;
- тупые боли в животе.
Весьма часто амилоидоз кишечника путают с и назначают операцию. Некоторые симптомы могут указывать на опухоль. То, что у больного амилоидоз кишечника, иногда обнаруживается только во время проведения операции. Временное улучшение пациента возможно, но, естественно, проблему это не решает. Диагностировать амилоидоз кишечника можно посредством нескольких клинических исследований.
Амилоидоз селезёнки образуется в результате отложения белка в её фолликулах. Как результат, поражённый орган увеличивается, становится более плотным.
Амилоидоз селезёнки протекает в двух стадиях:
- «саговая»;
- «сальная».
«Саговая» селезёнка
На этой стадии симптомов заболевания практически нет. Орган не увеличивается в размерах, нет каких-либо болезненных ощущений. Обнаружить нарушения можно только при сдаче анализов и проведении соответствующих обследований. Если своевременно начать лечение, то прогнозы по этому подтипу заболевания весьма прогрессивны.
«Сальная» селезёнка
На второй стадии орган становится больше в размерах, более уплотнённым и с «сальным» блеском. Добавляются симптомы общего недомогания, повышенной (37 градусов) температуры, возникают болезненные ощущения в области селезёнки. Лечение на данной стадии только одно – хирургическое вмешательство. Поражённый орган удаляется.
Лечение
Если не наблюдается тяжёлой формы, то стационар не всегда нужен. Чаще всего, это домашний постельный режим. Что касается медикаментозной терапии, то её можно будет назначать только после того, как будет проведено несколько клинических исследований. Корректное лечение амилоидоза подразумевает и правильное питание.
- длительный приём в пищу печени;
- ограниченное потребление соли и белковой пищи;
- потребление витаминов (прописывает врач).
В некоторых случаях возможно удаление органа или трансплантация. Лечение амилоидоза не подразумевает полное освобождение от недуга. У лиц пожилого возраста (от 50 лет и старше) осложнения протекают гораздо сложнее, так как иммунная система уже не в состоянии переносить такое количество антибиотиков и препаратов. Подтип АА лечится гораздо сложнее, чем тип А1.
Успех от лечения недуга зависит от того, на какой стадии обратиться к врачу и начать лечение. Если полностью устранить фоновое заболевание, то симптоматика амилоидоза тоже может исчезнуть.
Амилоид, его природа и свойства.
В 1853 году Вирхов показал, что вещества, выпадающие в тканях при "сальной болезни" Рокитанского, обладают свойством окрашиваться йодом подобно крахмалу и назвал его амилоидом.
Химический состав и физические свойства амилоида.
Амилоид является сложным веществом - гликопротеидом, в котором фибриллярные и глобулярные белки связаны с полисахаридами.
Белки амилоида .
По Кравкову (1894 год) в состав амилоида входят:
Углерод (48,86 - 50,38 %);
Водород (6,45 - 7,09 %);
Азот (13,79 - 14,67 %);
Сера (2,65 - 2,8 %);
Фосфор (следы).
Гилес и Калкинс (1955 год) обнаружили в амилоиде 82,8 % воды, до 14,2% азота, до 4% углеводов, 0,9% фосфора и 0,86% серы.
Амилоид дает характерные для белков биуретовую и ксантопротеиновую реакции. Большой процент содержания воды в амилоиде говорит о высокой гидрофильности белков, а низкое содержание фосфора предполагает, что он принадлежит к нуклеиновым кислотам, имеющимся в амилоиде хотя достоверных данных нет). Амилоид пиронинофилен.
Аминокислотный состав амилоида отличается от сывороточных и тканевых белков (в моль-процентах):
Глицин - 10-17,3;
Аланин - 9,7-14,4;
Лейцин - 7,7-13,7;
Валин - 4,1 - 7,1;
Метионин - 1,1;
Цистеин - 1,5 - 2,9;
Тирозин - 2,7-3,7;
Триптофан;
Гистидин.
В амилоиде преобладают липофильные группы (глицин, аланин, лейцин, валин).
Белковый компонент амилоида сходен с глобулинами. Величины содержания метионина и цистеина оказались близкими к тем, которые были получены при анализе гамма-глобулина сыворотки, хотя содержание аминокислот в амилоиде и в сывороточном гамма-глобулине различен.
Наличие триптофана свидетельствует о его близости к фибриногену, который также содержит эту аминокислоту в большом количестве. Амилоид содержит много тирозина (гиалин и коллаген). Качественно аминокислотный состав амилоида одинаков при различных формах амилоидоза, однако количественная характеристика компонентов, входящих в его состав колеблется в зависимости не только от формы амилоидоза, но и от органа, в котором амилоид выпадает.
На основании анализа аминокислотного состава Леттетер (1955 г.) заключил, что амилоид - смесь двух белков: один из них близок к глобулинам сыворотки, другой - к коллагену. Белки амилоида состоят из двух фракций, обладающих различными свойствами. Фракция А (85-90%) нерастворима в воде, осаждается уксусной кислотой, после осаждения в ацетатном или фосфатном буфере при рН 3,9 - 6,4, электрофоретически близка к альфа-1- и гамма-глобулинам сыворотки, обладает антигенными свойствами. Фракция В (10-15%) растворима в воде, осаждается спиртом, обладает электрофоретической подвижностью, близкой к бета-глобулинам.
Белки плазмы в составе амилоида рассматриваются как "добавки", появление которых объясняется неспецифической адсорбцией в амилоиде многих веществ в связи с особенностями его тонкофибриллярной структуры.
Углеводы амилоида.
Полисахариды составляют 2-4% общей массы амилоида и представлены эквивалентным количеством глюкозы, галактозы, несколько меньшим количеством галактозамина и гексозамина, маннозой, фруктозой. Углеводы состоят из двух фракций: нейтральной и кислой.
1. Первая фракция, PAS - положительная, не дает метахромазии, обладает электрофоретической подвижностью подобно альфа-2- и гамма-глобулинам сыворотки. Ее относят к сывороточным глюкопротеидам, что подтверждается высоким содержанием в амилоиде и сыворотке крови при амилоидозе гексозамина и нейраминовой кислоты, которые входят в состав углеводных групп, связанных с сывороточными глобулинами.
2. Вторая фракция метахроматична, основу кислых полисахаридов составляют хондроитинсульфат (90%), гепаритинсульфат, гиалуроновая кислота, хондроитин и гепарин. Мукополисахариды имеют не гематогенное, а местное соединительнотканное происхождение, причем увеличение МПС происходит без нарушения соотношения хондроитинсульфата и гепаритинсульфата, присущего нормальной ткани. По данным Muir и Cohen (1968 г.) помимо хондроитинсульфата (50%) и гепаритинсульфата (30%) входит кератинсульфат (20%).
Фракция А связана с PAS-положительными сывороточными полисахаридами, фракция В связана с кислыми мукополисахаридами (с толуидиновым синим дает метахромазию).
Помимо белков и углеводов в амилоиде обнаружены липиды и липопротеиды, соли кальция (добавки амилоида).
Физические свойства амилоида.
Из физических свойств для амилоида характерны положительная анизотропия и дихроизм. При окраске красным Конго усиливается двойное лучепреломление. Анизотропия амилоида свидетельствует об упорядоченной молекулярной структуре его вещества. Исходя из поляризационно-оптических свойств амилоида Romhanyi полагает, что он обладает тонкофибриллярной субмикроскопической паракристаллической структурой.
Прочность белково-полисахаридных связей объясняет устойчивость амилоида к действию ферментов (например: трипсин ведет к ослаблению PAS- реакции амилоида, но не изменяет ортохроматичное окрашивание и двойное лучепреломление).
Окрашивание амилоида Конго-красным определяется конформационными особенностями белков и его фибрилл.
Ультраструктурные компоненты.
В амилоиде найдены два ультраструктурных компонента: фибриллы и периодические палочки. Фибриллы имеют диаметр 7,5 нм и длиной до 800 нм. Каждая фибрилла состоит из двух субфибрилл диаметром 2,5 нм, которые расположены параллельно на расстоянии 2,5 нм. Фибриллы имеют исчерченность, лентовидную форму. Согласно Wolman (1971 г.) параллельные фибриллы белка и нейтральных полисахаридов амилоида переплетены фибриллами из кислых мукополисахаридов. Для фибриллярного белка амилоида (F-компонент) характерно высокое содержание триптофана, дикарбоксильной кислоты, коротких цепей аминокислот и малое содержание гидроксипролина, гидроксилизина - это отличает амилоид от коллагена, ретикулина, эластина. Фибриллы представляют гетерогенную группу белков с индивидуальными особенностями, в каждом случае амилоидоза аминокислотный состав фибриллярного белка различен. Из смеси белков фибрилл амилоида выделяют белок А (AS) и белок В. Белок А (AS), по сравнению с белком В содержит больше таких аминокислот, как аргинин, аспарагин, глицин, аланин и фенилаланин; имеет специфическую антигенную структуру. Белок В, найденный в амилоиде при первичном амилоидозе, опухолевом амилоидозе имеет большую относительную молекулярную массу, по аминокислотному составу напоминает легкие цепи иммуноглобулинов. Для белков амилоида характерна складчатая упаковка полипептидных цепей (кросс-бета-конформация).
Периодические палочки составляют 5 % по отношению к фибриллам. Диаметр их 10 нм, длина до 250 нм. Они состоят из пептагональных образований диаметром 9-10 нм и шириной 2 нм, расположенных друг от друга на расстоянии 4 нм. Они отличаются от фибрилл не только по количественному составу аминокислот (преобладают глицин, лейцин, глютамин и аспарагин, отсутствует триптофан), но и по составу углеводов (низкое содержание гексозамина и уроновой кислоты, высокое содержание нейраминовой кислоты и гексоз). По сравнению с белком фибрилл периодические палочки являются более сильным антигеном. Периодические палочки (Р-компонент) соответствуют альфа-глобулину плазмы.
Патогенез амилоидоза.
Для объяснения патогенеза амилоидоза было предложено много теорий. Так, например, Gzerny (1893 год) и Шепилевский (1899)рассматривали амилоид как продукт воспаления.
Н. П. Кравков (1898 год) считал, что амилоид образуется вследствие жизнедеятельности микроорганизмов; по А. А. Максимову (1896 год) амилоидное вещество появляется в результате тканевой дезорганизации. До настоящего времени не утратили своего значения 3 теории патогенеза амилоидоза: теория диспротеиноза, иммунологическая теория и теория клеточной и локальной секреции.
Теория диспротеиноза.
Создание этой теории связывают с именем Вирхова, который рассматривал амилоид как "продукт крови". Эта теория рассматривает амилоид как продукт нарушенного белкового обмена. Основным звеном в патогенезе является диспротеинемия с накоплением в плазме грубодисперсных белковых фракций и аномальных белков (парапротеинов), которые, выйдя за пределы сосудистого русла, образуют амилоидную субстанцию.
Хорошо известно, что развитию амилоидоза предшествует состояние диспротеинемии (гиперглобулинемия, гиперфибриногенемия, гипоальбуминемия, парапротеинемия и др.). Оно наблюдается при заболеваниях, ведущих к вторичному амилоидозу (туберкулез, ревматоидный артрит, хронический остеомиелит, лимфогранулематоз, плазмоцитома), при периодической болезни и при идиопатическом амилоидозе.
Амилоид при плазмоцитоме строится из легких цепей èììóíîãëîáóëèíà. Установлено сходство состава и последовательности аминокислот белка фибрилл амилоида (белка В) при плазмоцитоме с N-концевыми фрагментами легких цепей иммуноглобулина.
Диспротеинемия характеризует предамилоидную стадию. Это происходит при введении микроорганизмов, токсинов, белков и протеолитических ферментов. В этой стадии в крови прогрессирует нарастание гамма-глобулинов, чему предшествует увеличение альфа- и бетта-глобулинов и соответствующих глюкопротеидов. Происходит образование аномальных белков, отсутствующих в крови контрольных животных.
Джегер (1960 г.) отметил падение уровня аномальных гамма-глобулинов сыворотки при появлении амилоидной субстанции в тканях, связав этот факт с расходом аномальных белков на построение амилоида.
Прекращение инъекций амилоидогена вело к нормализации уровня сывороточных бетта-глобулинов и увеличению гамма-глобулинов, что сопровождалось резорбцией амилоида в селезенке и почке.
Существенным звеном в патогенезе амилоидоза, которое объясняется теорией диспротеиноза, является выделение циркулирующих в плазме белков (парапротеинов) в ткани. Амилоид образуется под эндотелием и аргирофильной мембраной сосуда, что свидетельствует о проницаемости сосудистой стенки для парапротеинов.
Процессы полимеризации и деполимеризации кислых МПС основного вещества легче реализуются и легче разрушаются близ эндотелиального барьера, где они осуществляются под влиянием плазматических и тканевых гиалуронидаз. Субэндотелиальное отложение амилоида отражают изменение в ферментной системе (гиалуронидаза), приводящих к нарушению физиологических ритмов полимеризации и деполимеризации: это определяет возможность соединения плазменных парапротеинов и глюкопротеидов с фибриллярным белком и МПС основной субстанции, что ведет к образованию амилоида.
Субэндотелиальная локализация амилоида свидетельствует в пользу теории, подчеркивающей первичное значение нарушений синтеза белков организма, она объясняет избирательную органную локализацию амилоида. Выделяемые из крови продукты нарушенного синтеза белков скапливаются за эндотелиальным барьером (в органах выделения и депонирования), с чем связано частое положение при амилоидозе почек, печени, кишечника и селезенки. Однако в своих положениях эта теория слишком прямолинейна и поэтому нуждается в поправках.
Диспротеинемия неспецифична для амилоидоза и является выражением нарушенного белкового обмена, свойственного хроническим гнойно-деструктивным процессам, гипериммунизации, аутоиммунизации, наследственным метаболическим заболеваниям. Теория диспротеиноза не учитывает роль клеточных трансформаций РЭС и не вскрывает механизм развития самой диспротеинемии. Она объясняет механизм образования специфического белка амилоида при плазмоцитоме и не в состоянии ответить, где и как образуются белки и глюкопротеиды, которые являются "строительным материалом" амилоидной субстанции.
Иммунологическая теория.
Основоположником этой теории, рассматривающей образование амилоида как результат реакции антиген-антитело, считается Loeschke (1927) и Letteter (1934) . Они исходили из того, что при заболеваниях, осложняющихся амилоидозом, образуются продукты распада тканей, лейкоцитов и токсины бактерий, которые могут обладать антигенными свойствами и вести к продукции антител. Образование амилоида является результатом реакции преципитации белкового комплекса в местах продукции антител (РЭС). Letteter нашел в крови животных при амилоидозе специфические для тканевых белков преципитины, доказав тем самым их аутоиммуную природу, и установил, что амилоидоз возникает при условии плохой выработки антител, при их недостаточном содержании в крови и тканях и избыточное количество антигенов. Так частота амилоидоза при нагноительных процессах косвенно указывает на значение в амилоидогенезе тканевого распада и распада лейкоцитов и развитие аутоиммуной реакции.
Исследования Janigan и Druet (1966) показали, что амилоидогенная способность различных растворимых белковых веществ повышается параллельно усилению их антигенных свойств. Приобретение антигенных свойств сопровождается появлением способности вызывать амилоидоз, при потере антигенности вещество лишается этой способности.
Mellors и Ortega (1956) показали, что амилоид может связаться с гомологичной антигамма-глобулиновой сывороткой по типу антиген-антитело, он содержит специфические антитела к антигену - амилоидогену, при этом локализация специфических антител совпадает с фиксацией гомологичных гамма-глобулинов.
В гистосерологических исследованиях Letteter, Lachmann (1969) нашли в амилоиде комплемент и, тем самым, показали участие реакции антиген-антитело в образовании амилоида. Позже в массах амилоида были найдены фиксирующие комплемент комплексы антиген-антитело.
В 1957 г. Парнес В.А. нашла в амилоидной селезенке больных, умерших от различных заболеваний, специфические антигеннные комплексы (аутоантигены). Она считает, что аутоантигенная природа амилоидоза обусловливает развитие процессов аутоиммунизации. Павлихина Л.В. и Серов В.В. пользуясь реакцией связывания комплемента, показали постепенное накопление противоорганных антител при амилоидозе. В поздние стадии амилоидоза происходило нарастание титра противоорганных антител. Амилоид имеет определенную специфику как аутоантиген.
Зубжицкий Ю.Н. (1967) обнаружил, что при экспериментальном амилоидозе мышей комплекс чужеродный антиген-гомологичное антитело обнаруживается в органах раньше, чем выявляются отложения амилоида. При этом разрушение тканей, сопровождающееся образованием амилоида, индуцируется действием комплекса антиген-антитело в условиях избытка чужеродного антигена. Появление противоорганных антител, обнаруженных в сыворотке мышей, наступает после начала разрушения тканей в ходе образования амилоида, что позволяет признать аутоантигены этих тканей аутоиммунизированными антигенами.
Фаза образования аутоиммуного комплекса, включающего антиген казеин (7S-антитело), сменяется фазой образования амилоидной субстанции, в состав которой входит антителоподобное вещество. Это вещество проявляет свойства 19S - антител и появляется после "истощения" способности плазматических клеток продуцировать нормальные иммуноглобулины.
Главную роль в развитии амилоида играет срыв гипериммунизации: снижение функции иммунокомпетентной системы, стимуляция клеточных трансформаций, ведущих к появлению клеток (амилоидобласты), секретирующих специфический фибриллярный белок амилоида.
Рокосуев В.С. (1975 г.) считает, что любая длительная антигенная стимуляция организма сопровождается выработкой каких-то неспецифических факторов ("неспецифический фактор стимулирующий амилоидогенез", "фактор переноса"), реализующих развитие амилоидоза. Установлено, что "фактор переноса", находящийся как-будто в клетках лимфоидной ткани, стимулирует выработку амилоида у мышей с недостаточным количество инъекций иммуногена при переносе его от мышей и людей, больных амилоидозом. "Фактор переноса" имеет нуклеопротеидную природу. При этом показано, что грубая ядерная фракция, извлеченная из гомогенатов селезенки амилоидных мышей, вызвала индукцию амилоидоза. То есть существует перенос информации клетками лимфоидной системы при амилоидозе, она переносится специфическим РНК-иммунным носителем.
Предполагают, что амилоид есть результат взаимодействия амилоидостимулирующего фактора и специфического антигена. При этом исключительной становится роль клеток (амилоидобласты), продуцирующих амилоид под влиянием амилоидопродуцирующего фактора в присутствии специфических антигенов.
При амилоидозе происходит угнетение клеточного иммунитета по мере прогрессирования процесса.
Таким образом, иммунологическая теория амилоидоза уточнила и дополнила представления о роли гуморальных иммунных реакций в образовании амилоидного вещества. Суждение, что "амилоид является комплексом антиген-антитело" не может быть принято, но это не значит, что иммунные комплексы не могут входить в состав амилоида как гематогенные "добавки". Присутствие иммунных комплексов с амилоиде свидетельствует о роли реакции гуморального иммунитета в образовании амилоида.
В 1973 г. Hardt привел следующие факты: к амилоидозу приводит сильная антигенная стимуляция; клетки, "занятые" в предамилоидной и амилоидной фазе, известны как "медиаторы иммунных реакций"; в амилоидной фазе наблюдается нарушение функции иммунокомпетентных клеток, и эти нарушения коррелируют с изменениями в лимфоидных органах; амилоидные фибриллы состоят из компонентов иммуноглобулинов. Длительная антигенная стимуляция приводит к распаду Т-лимфоцитов с высвобождением веществ нуклеопротеидной природы, которые вместе со специфическим антигенами вызывают продукцию фибрилл амилоида мезенхимальными клетками, то есть нарушается гуморальный и клеточный иммунитет. Эти нарушения определяют истощение лимфоидной ткани и появление пула клеток (амилоидобластов), способных секретировать аномальный фибриллярный белок, который при соединении в тканях с другими белками и полисахаридами образует сложный гликопротеид - амилоид.
Иммунологическая теория вскрывает важное звено в патогенезе амилоидоза - изменение иммунного гомеостаза. Она позволяет объяснить экспериментальный амилоидоз и вторичный амилоидоз у человека (исключая параамилоидоз), но неприложима к идиопатическому и генетическому амилоидозу.
Мутационная теория.
Эта теория образования клона клеток-амилоидобластов может стать универсальной в объяснении патогенеза всех известных форм амилоидоза, если представить возможное разнообразие мутагенных факторов.
При вторичном амилоидозе (исключая амилоидоз при плазмоцитоме) мутации и появление клона амилоидобластов связаны с длительной антигенной стимуляцией.
При генетическом (семейном) амилоидозе речь идет о мутации гена, которая происходит в различных локусах, чем и определяется различие в составе амилоидного белка у разных людей и животных. При старческом амилоидозе имеют место подобные механизмы, так как старческий амилоидоз рассматривают как фенокопию генетического. Клеточные мутации при параамилоидозе и, возможно, при опухолевидном локальном амилоидозе обусловлены опухолевыми мутагенами. Поскольку предшественники амилоида - амилоидные фибриллы (их белки) являются слабыми иммуногенами, мутирующиеся клетки не распознаются иммунокомпетентной системой и не элиминируются. Возникает иммунологическая толерантность по отношению к белкам амилоида.
Мутационная теория амилоидогенеза позволила понять близость амилоидоза к опухолевому процессу.
Говоря о конкретных взаимоотношениях амилоидоза и опухоли выделяют три варианта сочетаний:
1. Амилоидоз "осложняет" опухоль, обычно рак той или иной локализации. Развивается вторичный амилоидоз, причем механизм амилоидогенеза идентична таковому при туберкулезе и хронических нагноениях.
Основные звенья:
а) деградация комплексов антиген-антитело макрофагами, активация продуктами деградации пиронинофильных и PAS - положительных клеток и синтез амилоида амилоидобластами при помощи "фактора переноса", освобождающегося из пиронинофильных клеток.
2. Амилоидоз при ретикулезах (плазмоцитоме, ретикулосаркоме, лимфогранулематозе, болезнь Вальденштрема).
Развивается генерализованный амилоидоз, однако развитие его в этих случаях связывается с опухолевой пролиферацией клеток типа ретикулярных, плазмоцитов и лимфоцитов. При этом имеются факты, что амилоид при гемобластозах (парапротеинемических) прямо или опосредованно являются продуктом опухолевых клеток. в норме элементы линии "ретикулярная клетка - плазмоцит" синтезируют иммуноглобулины, а в процессе опухолевой трансформации - миеломные белки, чаще L - цепи иммуноглобулинов, из которых строится амилоид. предполагают, что легкие цепи иммуноглобулинов захватываются макрофагами, которые перерабатывают L - цепи и строят из этих фрагментов амилоид. L - цепи являются филогенетически более примитивными вариантами "предшественников иммуноглобулинов".
3. Амилоидоз стромы доброкачественных или злокачественных опухолей. Чаще это опухоли эндокринных органов или представители паракринной системы: медуллярный рак щитовидной железы, инсулома, карциноиды, кожные и одонтогенные опухоли - опухоль Тередберга. В этом случае в образовании амилоида участвуют клетки эпителиальные опухолевые клетки. В медуллярном раке щитовидной железы амилоид продуцируется парафолликулярными С-клетками, которые в норме производят кальцитонин. В инсуломах В-клетки производят амилоид или инсулин, для белковой молекулы которого, так же как для амилоида и кератина, характерно обилие дисульфидных связей. По-видимому, с этой "ошибочной" продукцией В-клетками амилоида вместо инсулина связан старческий амилоидоз островков Лангерганса (компонент триады Шварца), а с продукцией клетками эпидермиса вместо кератина амилоида - локальный кожный амилоидоз.
Связь между раковой клеткой и амилоидом при эндокринных полипептидных опухолях ("апудомах"), которые в норме продуцируют полипептиды, а в результате опухолевой трансформации наряду с другими проявляющимися признаками опухолевого прогрессии начинают синтезировать аномальный белок- "апуд- амилоид".
Таким образом, амилоид является продуктом клетки, претерпевшей опухолевую эволюцию.
Между амилоидогенезом и онкогенезом можно найти много общего. Так, признак прогрессии в амилоидозе представлен безудержным размножением недифференцированных клеток РЭС. Бесконтрольно прогрессирующую продукцию аномального белка амилоида пролиферирующими клетками особого типа можно рассмотреть как вторичный признак прогрессии (анаплазия), которая развивается автономно. Предполагают, что клетками, способными к опухолевой эволюции, является "пул" дремлющих примитивно устроенных клеток, подверженных соматическим мутациям (клетки, синтезирующие амилоидные фибриллы): это амилоидобласты, являющиеся производными камбиальных клеточных элементов мезенхимального происхождения.
Взаимоотношения амилоидоза и опухоли с позиций нарушения ферментативного баланса клетки (ферментопатия). В основе действия онкогенного фактора (вирус, соматическая мутация), по-видимому, лежит ферментопатия, главным образом РНК). Если понимать процесс "дисдифференцировки" и опухолевую эволюцию клеток как ферментопатию, обусловленную нарушением работы ферментов, связанных с обменом нуклеиновых кислот, то "дисдифференцировка" клеток с образованием амилоидобластов и синтезом амилоидного фибриллярного белка следует связать с нарушением работы ферментов, контролирующих синтез фибриллярных белков. Считают, что первичный дефект при амилоидозе заключается в нарушении синтеза нуклеопротеидов, что свидетельствует о близости тонких механизмов онко- и амилоидогенеза. В основе извращений функции клетки, ведущих к синтезу аномального фибриллярного белка, лежит мутация гена, отвечающего за выработку белка.
Генетический амилоидоз, развивающийся в связи с мутацией гена, этот амилоидоз относят к полигенным заболеваниям, развитие которых зависит от нарушения не одного фермента, а их комплекса.
Амилоид образуется в тех опухолях, которые относятся к генетически зависимым: медуллярный рак щитовидной железы, множественный эндогенный аденоматоз, опухоли при иммунодефицитных заболеваниях.
Гуморальные нарушения (диспротеинемия, извращения иммуногенеза), как и клеточные (синтезирующие белок амилоида) могут возникнуть после того или иного заболевания или быть его выражением (опухоль), могут явиться проявлением возрастаюших изменений обмена тканевой структуры или быть наследственными, отражая индивидуальную структуру белкового обмена.
Таким образом, мутационный механизм ведет к появлению амилоидобластов, секретирующих специфичный белок амилоида.
Морфогенез амилоидоза.
Морфогенез амилоидоза складывается из следующих звеньев:
1. Клеточные трансформации РЭС с появлением клона клеток, способных к синтезу фибриллярного белка амилоида.
2. Синтез амилоидобластами основного компонента амилоида - фибриллярного белка (фибриллы).
3. Агрегация фибрилл с образованием "каркаса" амилоидной субстанции.
4. Соединение агрегированных фибрилл с белками и глюкопротеидами плазмы, а также с кислыми МПС и образование сложного глюкопротеида - амилоида.
Клеточные трансформации РЭС составляют сущность предамилоидной стадии, которая изучена при вторичном амилоидозе.
Предамилоидная стадия - пиронинофильная стадия, характеризующаяся плазматизацией органов РЭС (селезенки, костного мозга, лимфатических узлов и печени) и в других органах (клубочки почек, перибронхиальная соединительная ткань, строма миокарда). Богатые РНК пиронинофильные клетки отличаются высокой активностью окислительно-восстановительных ферментов (глюкозо-6-фосфатдегидрогеназа). По мере снижения пиронинофилии в клетках увеличивается количество гидролитических ферментов (PAS - положительные клетки).
Клеточные трансформации РЭС в предамилоидной стадии обязаны двум классам клеток - плазмоцитам и лимфоцитоподобным.
В селезенке наряду с плазматическими клетками, которые в этой стадии преобладают, увеличивается количество ретикулярных клеток с гиперплазированной гранулярной ЭПС и множеством полисом.
В печени плазматические клетки и лимфоцитоподобные клетки постоянно обнаруживаются в синусоидах.
В почках плазматические и лимфоцитоподобные клетки видны в межканальцевой строме.
Таким образом, клеточные трансформации в предамилоидной стадии обязаны гиперплазии плазматическим и лимфоцитоподобным клеткам.
Синтез фибриллярного белка амилоида клетками мезенхимального происхождения.
1. фибробласты, близкие к ретикулярной клетке, ответственные за продукцию белка ретикулина;
2. фибробласты, продуцирующие белок соединительной ткани - тропоколлаген.
Помимо фибробластов, синтез фибрилл амилоида связывают с эндотелиальными клетками.
Источниками амилоидобластов являются:
1. В селезенке - ретикулярные и плазматические клетки.
2. В печени - купферовы клетки, способные при определенных условиях синтезировать и другой фибриллярный белок - тропоколлаген.
3. В почках (их клубочках) отложение фибрилл амилоида чаще обнаруживается в мезангиуме; амилоидобластами становятся мезангиальные клетки, которые в норме выполняют роль модифицированных фибробластов, секретирующих тропоколлаген базальной мембраны капилляров клубочка, а также и роль макрофага.
Агрегация фибрилл амилоида с образованием "каркаса" амилоидной субстанции зависит от гуморальных и тканевых (клеточных факторов).
Среди гуморальных факторов имеют значение дисульфидные связи и сульфгидрильные группы амилоида, участвующих в агрегации белков в стабильные макроструктуры.
При образовании фибрилл амилоида, который является аномальным белком, закономерны клеточные реакции резорбции - фибриллоклазии.
Возникает как бы единоборство синтеза фибриллярного белка амилоида и его резорбции, единоборство амилоидобластов и амилоидокластов. Оно заканчивается в пользу синтеза фибриллярного белка амилоида, что объясняется развитием толерантности к амилоидному белку. Толерантность к белку фибрилл амилоида, выражением которого является недостаточная и несостоятельная амилоидоклазия, может рассматриваться как одна из главных причин накопления амилоидного вещества в тканях.
Амилоидокласты ультраструктурно отличаются от амилоидобластов. В их цитоплазме отсутствует гранулярная ЭПС, рибосомы, митохондрии, редко появляется гладкая ЭПС. Цитоплазма заполнена включениями с одноконтурной мембраной, содержащими амилоидные фибриллы. Включения отражают этапы "переваривания" фибриллярного белка амилоида (фибриллы характеризуются разным расположением, фаголизосомы, липидные капли).
В селезенке роль амилоидокластов выполняют свободные и фиксированные макрофаги гематогенного происхождения.
В печени - купферовы клетки.
Таким образом, агрегация фибрилл амилоида связана с двумя сопряженными разнонаправленными процессами - синтезом фибрилл и их резорбцией.
Преобладание синтетических процессов над резорбтивными (амилоидобластов над амилоидокластами) в силу восстановления иммунологической толерантности к белку амилоида определяет возможность образования фибриллярного каркаса амилоидной субстанции.
Соединение фибрилл амилоида с белками и гликопротеидами плазмы и кислыми МПС ткани представляет заключительный этап формирования амилоидного вещества.
Образование амилоида происходит вне клеток, в тесной связи с волокнами соединительной ткани - ретикулярными, либо коллагеновыми. Отношение амилоидной субстанции к разным волокнам связано с участием различных клеток (плазматические, ретикулярные клетки или фибробласты) в построении фибриллярного белка амилоида.
Существует два вида амилоида в зависимости от отношения его к фибриллярным структурам соединительной ткани - периретикулярный и периколлагеновый.
Для периретикулярного амилоида, который выпадает по ходу содержащих ретикулин мембран сосудов и желез, а также по ходу ретикулярой стромы паренхиматозных органов, типично поражение селезенки, печени, почек, надпочечников, кишечника, интимы сосудов мелкого и среднего калибра.
Для периколлагенового амилоида, который образуется по ходу коллагеновых волокон, характерно преимущественное поражение адвентиции сосудов крупного и среднего калибра, стромы миокарда, поперечно-полосатой и гладкой мускулатуры, нервов, кожи (мезенхимальный амилоидоз).
На заключительном этапе амилоидогенеза увеличивается сосудистая проницаемость, она облегчает соединение фибриллярного белка амилоида и МПС ткани с белками и глюкопротеидами плазмы крови и определяют присутствие в амилоиде гематогенных "добавок".
Прогрессирующий амилоидоз ведет к функциональной недостаточности органа, ведет к атрофии его паренхиматозных элементов и склерозу. Орган увеличивается в объеме, становится плотным и ломким, имеет восковидный или сальный вид на разрезе; в финале развивается амилоидное сморщивание.
Амилоидоз может быть генерализованным (общий, распространенный амилоидоз) или местным (локальный).
Классификация амилоидоза.
В 1929 г. Lubarsh писал, что первичный амилоидоз отличается от вторичного отсутствием предшествующего или сопутствующего "причинного" заболевания, более частым поражением мезодермальных тканей, по сравнению с паренхимными (сердечно-сосудистая система, пищеварительный тракт, поперечно-полосатые и гладкие мышцы кожи). Причины первичного амилоидоза неизвестны, хотя учитывается подобие типов наследственного и первичного амилоидоза.
Таблица 1.
Классификация амилоидоза Heller и соав. (1984).
| Форма | Вид отложений | амилоидоза |
| амилоидоза | периретикулярный | периколлагеновый |
Генетический (наследственный) |
Семейная средиземноморская лихорадка (периодическая болезнь). Амилоидоз с лихорадкой, крапивницей и глухотой (форма Muckle и Wells) | Нейропатический амилоидоз с преимущественным поражением нижних (Andrade, Horta) или верхних (Rukavina) конечностей. Кардиопатический амилоидоз (Frederiksen). |
Приобретенный (вторичный) |
Ассоциированный с хроническими инфекциями, коллагеновыми болезнями, злокачественными опухолями. | Ассоциированный с множественной миеломой |
| Идиопатический (первичный) | Нефропатический |
Классический (системный). Нейропатический. Кардиопатический. Локальный. |
Причинами вторичного амилоидоза может быть туберкулез, который конкурирует с гнойно-деструктивными процессами в легких, а также велика роль в возникновении амилоидоза ревматоидного артрита и остеомиелита. Амилоидоз при миеломной болезни (плазмоцитома) выделен в самостоятельную форму, поскольку он занимает промежуточное положение между вторичным и первичным: так как при вторичном имеется "причинное" заболевание - миелома, однако характер распределения (сосуд, локализация) и химико-тинкториальные свойства амилоидного вещества ближе к первичной форме амилоидоза.
Некоторые исследователи полагают, что механизм образования амилоида при миеломной болезни в отличие от типичного амилоидоза более простой и сводится к диффузии в ткани микромолекулярного сывороточного белка Бенс-Джонса, который вступает в реакцию "белок- белок" или "белок- полисахариды", что ведет к преципитации нерастворимового параамилоида.
Однако в настояшее время имеются доказательства в пользу того, что при плазмоцитоме фибриллярный белок амилоида строится из лёгких цепей иммуноглобулина, секретируемого миеломной клеткой.Таков же механизм образования при парапротеинемических гемобластозах.
В 1961 году Бриггс восполнил классификацию амилоидоза:
1) Первичный амилоидоз (отсутствие предраспологающего заболевания)
а) генерализованный
б) семейный
в) респираторного тракта (опухолевидный, узловатый и диффузный)
2) Вторичный амилоидоз (наличие предраспологающего заболевания)
3) Старческий амилоидоз (сердца)
4) Амилоидоз при миеломной болезни
5)Опухолевидный локализованный амилоидоз (кроме амилоидоза респираторного тракта).
Гафни в 1964 году свёл клинико-морфологические особенности наследственного амилоидоза к трём типам:
1) нефропатический, проявляющейся нефротическим синдромом с уремией в финале заболевания
2) нейропатический, характеризующийся полиневритом с мышечной атрофией, импотенцией, кишечными расстройствами и кахексией
3) кардиопатический, характеризующийся сердечной недостаточностью.
Исходя из материалов последних лет по изучению амилоидоза,
Серов В.В. предлагает классификационную схему амилоидоза, которая учитывает:
1) Форму амилоидоза в зависимости от причинного фактора;
2) Возможный патогенетический механизм;
3) Клинический тип амилоидоза в зависимости от преобладания поражений того или иного органа или системы;
4) Морфогенетический вид в связи с особенностями периретикулярного или периколлагенового расположения амилоидной субстанции;
5) Клинико-морфологический вариант амилоидоза-паренхиматозный или мезенхимальный.
Существуют ряд общих признаков, которые объединяют амилоидоз в целом. Это, во-первых, диспротеинемия,которая является выражением нарушенного обмена, а возможно, и особенностей процесса обновления белков тела; во-вторых, единая роль трансформации клеток РЭС в возникновении фибриллярной структуры амилоида, независимо от того, является ли эта трансформация реактивной, неопластической или она обусловлена генетически; в-третьих, предшествующиепоявлению амилоида субмикроскопические изменения элементов системы соединительной ткани; в-четвёртых, единая субмикроскопическая структура амилоида.
Таблица № 2. Классификация амилоидоза.
Основной механизм развития |
Клинический тип |
Морфологический вид |
Клинико-морфологический вариант |
|
| Идиопатический (первичный) | Неизвестен | Системный Кардиопатический Нейропатический Нефропатический Энтеропатический Гепатопатический |
Периколлагеновый Периретикулярный |
Мезенхимальный Паренхиматозный |
| Наследственный (генетический) | ||||
| 1) периодическая болезнь (семейная средиземноморская лихорадка) | Нефропатический | >> | >> | |
2) семейный амилоидоз с лихорадкой, крапивницей, глухотой |
Генетический дефект синтеза фибриллярных белков тела (наследственная ферментопатия) |
>> | >> | >> |
| 3) семейный амилоидоз с аллергическими проявлениями, лихорадкой и нефропатией) | >> | >> | ||
| 4) семейный нейропатический амилоидоз | Нейропатический | Периколлагеновый | Мезенхимальный | |
| тип I, португальский | ||||
| 1 | 2 | 3 | 4 | 5 |
| тип III | ||||
| тип IV | ||||
| 5) семейный кардиопатический амилоидоз | Кардиопатический | >> | >> | |
Приобретенный (вторичный) 1) амилоидоз как осложнений хронических инфекций, коллагеновых болезней и злокачественных опухолей |
Нарушение иммунологического гомеостаза |
Нефропатический Эпинефропатический Гепатопатический Смешанный |
Периретикулярный Периколлагеновый |
Паренхиматозный Мезенхимальный |
| 2) параамилоидоз | Неопластическая трансформация клеток белково-синтетической системы | |||
| Старческий амилоидоз | Инволютивные нарушения обмена белка. возрастная брадитрофия |
Кардиопатический | >> | >> |
| Локальный опухолевидный | Неизвестен |