Влияние ритма питания на гормональный статус. Гормональные исследования и нормы гормонов в крови. Под влиянием инсулина в печени ускоряются
В курсе доступным языком даны сегодняшние взгляды на роль гормонов в организме.
Рассмотрены вопросы метаболизма белков, жиров и углеводов и гормоны, с ними связанные.
Отдельный раздел посвящен лимфатической системе и нарушениям движения лимфы, даны способы коррекции этих состояний.
Изложен современный взгляд на биологически активные добавки (БАДы), даны рекомендации по их выбору и применению.
Описаны частые симптомы и состояния: выпадение волос, ломкость ногтей, сухость кожи и слизистых, менопауза, сахарный диабет, ожирение, а так же влияние гормонального статуса на жизнь и сексуальную активность.
ПРОГРАММА КУРСА
Часть 1. Вступление. Определение цели визита пациента
Часть 3. Чего хотят пациенты на разных этапах жизни
Психосоматический взгляд на проблемы клиентов. Изменение запросов клиентов в зависимости от возраста. Когда включаются гормоны. Отличие мужских и женских клиентских запросов. Противозачаточные средства. Беременность и лактация. Динамика сексуальной активности мужчин и женщин.
Часть 4. Ведение в эндокринологию. Гормоны
Роль гормонов в регуляции организма. Гипофиз и его гормоны. Механизм действия гормонов на примере цепочки гипофиз - щитовидная железа - действие - обратная связь. Участие микроэлементов в нормализации работы гормонов. Выработка и действие гормона роста и красоты. Суточное расписание выработки гормонов. За что отвечает каждый гормон. Мелатонин, его препараты, действие. Как нормализовать свой суточный ритм.
Часть 5. Возрастные изменения. Теории старения
Внутриклеточные процессы. Теория свободных радикалов. Механизм разрушения мембраны свободными радикалами. Правильное питание для регенерации клеток. Влияние эмоций на гормональный фон и старение. Практический прием телесно-ориентированной терапии. Теория теломеров. Гормональная теория старения. Взаимосвязь гормонов и старения. Эмоции, гормональные нарушения и старение.
Часть 6. Гормональное питание. Белки
Обзор функций белков. Катаболизм белков в аминокислоты. Анаболизм аминокислот в гормоны и другие белковые структуры. Действие ферментов. Обзор белковых гормонов. Тестостерон - белок социальных и сексуальных амбиций. Суточная норма употребления белка. Диапазон нормальных значений содержания белка. Интепретация лабораторных анализов и нормализация содержания белка. Симптоматика недостатка белка: частые болезни, проблемы пищеварения, выпадение волос, ломкость ногтей, дефицит роста у детей, снижение либидо.
Часть 7. Гормональное питание. Жиры
Виды жиров. Функции липидов. Жировые гормоны. Роль и катаболизм холестерина-прогестерон - ДГА - тестостерон - эстрадиол. Важная роль витамина D: профилактика остеопороза, рака, бесплодия. Действие противозачаточных средств на метаболизм холестерина и гормонов. Взаимосвязь жирового обмена и заболеваний желудочно-кишечного тракта. Жировой обмен и менструальный цикл. Методы коррекции цикла через восстановление липидного обмена. Суточная норма употребления жиров. Препараты кальция и витамина D. Схема назначения и показания. Симптоматика недостатка жиров и коррекция состояний: кожные высыпания, нарушения теплообмена, эмоциональное и интеллектуальное состояние, старение, нарушения артериального давления, нарушения иммунитета, атеросклероз, ожирение, остеопороз, инфаркт, инсульт, заболевания суставов.
Часть 8. Гормональное питание. Углеводы
Виды углеводов. Какие углеводы нужны для каких видов деятельности. Механизм образования жира. Метаболизм глюкозы и инсулина. Нормальные показатели, из значение и интерпретация. Объективные визуальные показатели нарушений обмена инсулина (темные локти и подмышечные впадины). Норма содержания сахара крови. Механизм возникновения сахарного диабет, его типы и методы коррекции. Как правильно питаться для коррекции и профилактики нарушений углеводного обмена. Индивидуальные нормы употребления калорий. Правильное суточное распределение белков, жиров и углеводов для хорошего самочувствия, профилактики лишнего веса и улучшения сексуальных отношений и качества жизни. Рекомендации для детей и мужа. Приложение Fatsecret
- одно из лучших решений для подсчета калорий.
Часть 9. Гормональное старение
Четыре признака здоровой женщины. Причины непроизвольного мочеиспускания и коррекция состояния. Четыре признака здорового мужчины. Всегда ли частое/ночное мочеиспускание связано с простатитом. Как сохранить гормональную молодость. Климакс - это заболевание! Что происходит в организме с возрастом. Предменопаузальные симптомы и их коррекция: утомляемость, раздражительность, локальные жировые отложения и др. Какие лабораторные анализы смотреть и в какой день цикла. Изменение состояния после удаления матки. Особенности кровоснабжения яичников. Коррекция состояния после операции. Как связан гирсутизм (волосы на лице) и инсулиновый обмен. Коррекция гирсутизма.
Часть 10. Гормоны долголетия
Гормоны щитовидной железы, половые гормоны и гормон роста. Референсные нормы содержания. Периодичность сдачи анализов. Правильный уровень ТТГ для рождения здорового ребенка. Метаболизм ТТГ. Хронокосметология. Эндокринологический взгляд на лучшее время проведения процедуры. Как именно половые гормоны действуют на наше поведение. Коррекция не комфортных состояний. Какие гормоны являются маркерами правильного лечения пациентов.
Тактика исследований и назначений коррекции гормонального старения. Связь жирового гепатоза печени с гормональным статусом клиента. Краткое содержание пройденного материала.
Часть 11. Ожирение
Ожирение это симптом более серьезного заболевания. Виды и причины ожирения. Является ли вес маркером ожирения. Причины ожирения. Почему всегда хочется есть? Как действуют усилители вкуса. Гормональный механизм действия.
Индекс массы тела. Формула и правдивость измерения. Простой способ измерения ИМТ. 1 кг. жира = 20 километров новых сосудов. Биоимпеданс: точное измерение состава тела. Практический пример измерения. Интерпретация полученных данных. Рекомендации.
Часть 12. Лимфатическая система
Как отличить ожирение от отёков. Виды отёков. Функции лимфы. Иммунная, противовирусная и антибактериальные функции лимфатической системы. Сосудистый механизм застоя лимфы. Тканевые и клеточные нарушения, приводящие к отёкам.
Повышение артериального давления на 20 мм. рт. ст. увеличивает выпот жидкости в ткани в 68 раз! Симптомы нарушений работы лимфатической системы: пастозность, снижение температуры конечностей, потливость, изменение цвета кожи, воспалительные элементы на коже, геморрой, мастит, фиброзно-кистозные нарушения и еще 10 симптомов. Правильные методы дренажа лимфатической системы. Роль водного обмена в лимфатическом обмене. Формула расчета необходимого количества воды. Роль гормонов в возникновении отёков. Методы коррекции и лечения.
Часть 13. БАДы к пище
Биологические активные добавки (БАД). Обоснование важности приема БАДов. Нормы содержания веществ и параметры капсулы правильного БАДа. Состав и содержание БАДов. Примеры правильных добавок. Как правильно назначать и принимать БАДы. Дефицит витамина D. Симптомы, коррекция, назначение препаратов, содержащих витамин D. Обзор различных видов продуктов: гинко-билоба, тиофтовая кислота (берлитион, тиофтоцид), селен, астрагал (аргинин), лизин, ДГА, L-тирозин и др. Показания, противопоказания и побочные эффекты. Гормональный механизм действия БАДов.
Часть 14. Окончание семинара. Проверка достижения целей участниками группы
Заключительная часть. Как, обладая новыми знаниями, помогать клиенту. Общий алгоритм приема клиента: цель - жалобы - анамнез - процедура - совет (психологическая поддержка, коррекция питания) - обратная связь. Возвращаемся к целям на семинар. Обратная связь от каждого участника о том достигнута ли заявленная цель. Благодарности. Отзывы.
ОГРАНИЧЕНИЯ
Курс предназначен для информирования. По окончании Вашего обучения Вы не приобретаете новой для Вас специальности и/или квалификации
Чтобы получить доступ ко всем материалам курса, Вам необходимо нажать на кнопку «Получить доступ», выбрать способ оплаты, выписать счет на оплату на тот вариант, который Вы выбрали — и оплатить его в течение 3 банковский дней, а затем сообщить об оплате в службу поддержки по адресу [email protected]
В течение 24 часов после зачисления оплаты (не считая выходных и праздничных дней) Вам будет выслан курс (если Вы выбрали физическую версию на дисках).
В случае, если Вы выбрали on-line версию, Вы получаете доступ сразу, как оплата поступит на наш счет.
Вы получите уведомление от платежной системы о поступлении денег.

Если Вы решите, что наши модели, практики и стратегии вам не подходят, мы, естественно, возвратим Вам все деньги, но больше не сможем ничего вам продать из наших материалов или тренингов.
То есть, запрашивая возврат денег в течении 60 дней после покупки, вы подтверждаете согласие с тем, что более никогда не сможете ничего у нас купить или принимать участие в наших тренингах.
Если мы друг другу не подходим, то и не стоит тратить на это время.
Структура модуля | Темы |
Модульная единица 1 | 11.1. Роль гормонов в регуляции метаболизма 11.2. Механизмы передачи гормональных сигналов в клетки 11.3. Строение и синтез гормонов 11.4. Регуляция обмена основных энергоносителей при нормальном ритме питания 11.5. Изменение метаболизма при гипо- и гиперсекреции гормонов |
Модульная единица 2 | 11.6. Изменения гормонального статуса и метаболизма при голодании 11.7. Изменения гормонального статуса и метаболизма при сахарном диабете |
Модульная единица 3 | 11.8. Регуляция водно-солевого обмена 11.9. Регуляция обмена кальция и фосфатов. Строение, синтез и механизм действия паратгормона, кальцитриола и кальцитонина |
Модульная единица 1 РОЛЬ ГОРМОНОВ В РЕГУЛЯЦИИ МЕТАБОЛИЗМА. РЕГУЛЯЦИЯ ОБМЕНА УГЛЕВОДОВ, ЛИПИДОВ, АМИНОКИСЛОТ ПРИ НОРМАЛЬНОМ РИТМЕ ПИТАНИЯ
Цели изучения Уметь:
1. Применять знания о молекулярных механизмах регуляции обмена веществ и функций организма для понимания биохимических основ гомеостаза и адаптации.
2. Использовать знания о механизмах действия гормонов (инсулина и контринсулярных гормонов: глюкагона, кортизола, адреналина, соматотропина, йодтиронинов) для характеристики изменений энергетического обмена при смене периодов пищеварения и постабсорбтивного состояния.
3. Анализировать изменения метаболизма при гипо- и гиперпродукции кортизола и гормона роста, болезнь и синдром Иценко-Кушинга (акромегалия), а также при гипер- и гипофункции щитовидной железы (диффузный токсический зоб, эндемический зоб).
Знать:
1. Современную номенклатуру и классификацию гормонов.
2. Основные этапы передачи гормональных сигналов в клетку.
3. Этапы синтеза и секреции инсулина и основных контринсулярных гормонов.
4. Механизмы поддержания в крови концентрации основных энергоноси-
телей при нормальном ритме питания.
Тема 11.1. РОЛЬ ГОМОНОВ В РЕГУЛЯЦИИ МЕТАБОЛИЗМА
1. Для нормального функционирования многоклеточного организма необходима взаимосвязь между отдельными клетками, тканями и органами. Эту взаимосвязь осуществляют:
нервная система (центральная и периферическая) через нервные импульсы и нейромедиаторы;
эндокринная система через эндокринные железы и гормоны, которые синтезируются специализированными клетками этих желез, выделяются в кровь и транспортируются к различным органам и тканям;
паракринная и аутокринная системы посредством различных соединений, которые секретируются в межклеточное пространство и взаимодействуют с рецепторами либо близлежащих клеток, либо той же клетки (простагландины, гормоны желудочно-кишечного тракта, гистамин и др.);
иммунная система через специфические белки (цитокины, антитела).
2. Эндокринная система обеспечивает регуляцию и интеграцию метаболизма в разных тканях в ответ на изменения условий внешней и внутренней среды. Гормоны функционируют как химические посредники, переносящие информацию об этих изменениях в различные органы и ткани. Ответная реакция клетки на действие гормона определяется как химическим строением гормона, так и типом клетки, на которую направлено его действие. Гормоны присутствуют в крови в очень низкой концентрации, и их действие обычно кратковременно.
Это обусловлено, во-первых, регуляцией их синтеза и секреции и, во-вторых, высокой скоростью инактивации циркулирующих гормонов. Основные связи между нервной и эндокринной системами регуляции осуществляются с помощью специальных отделов мозга - гипоталамуса и гипофиза. В системе нейрогуморальной регуляции существует своя иерархия, вершиной которой является ЦНС и строгая последовательность протекания процессов.
3. Иерархия регуляторных систем. Системы регуляции обмена веществ и функций организма образуют три иерархических уровня (рис. 11.1).
Первый уровень - центральная нервная система. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса, который в синапсе вызывает освобождение медиатора. Медиаторы вызывают изменения метаболизма в эффекторных клетках через внутриклеточные механизмы регуляции.
Второй уровень - эндокринная система - включает гипоталамус, гипофиз, периферические эндокринные железы, а также специализированные клетки некоторых органов и тканей (ЖКТ, адипоциты), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула.
Третий уровень - внутриклеточный - составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:
Изменения активности ферментов путем активации или ингибирования;
Изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их деградации;
Изменения скорости транспорта веществ через мембраны клеток. Синтез и секреция гормонов стимулируется внешними и внутренними
сигналами, поступающими в ЦНС. Эти сигналы по нервным связям поступают в гипоталамус, где стимулируют синтез пептидных гормонов (так называемых рилизинг-гормонов) - либеринов и статинов. Либерины и статины транспортируются в переднюю долю гипофиза, где стимулируют или тормозят синтез тропных гормонов. Тропные гормоны гипофиза стимулируют синтез и секрецию гормонов периферических эндокринных желез, которые поступают в общий кровоток. Некоторые гипоталамические гормоны сохраняются в задней доле гипофиза, откуда секретируются в кровь (вазопрессин, окситоцин).
 Изменение
концентрации метаболитов в клетках-мишенях по механизму отрицательной
обратной связи подавляет синтез гормонов, действуя либо на эндокринные
железы, либо на гипоталамус; синтез и секреция тропных гормонов
подавляется гормонами периферических желез.
Изменение
концентрации метаболитов в клетках-мишенях по механизму отрицательной
обратной связи подавляет синтез гормонов, действуя либо на эндокринные
железы, либо на гипоталамус; синтез и секреция тропных гормонов
подавляется гормонами периферических желез.
ТЕМА 11.2. МЕХАНИЗМЫ ПЕРЕДАЧИ ГОРМОНАЛЬНЫХ СИГНАЛОВ В КЛЕТКИ
Биологическое действие гормонов проявляется через их взаимодействие с клетками, имеющими рецепторы к данному гормону (клетками-мишенями). Для проявления биологической активности связывание гормона с рецептором должно приводить к образованию химического сигнала внутри клетки, который вызывает специфический биологический ответ, например, изменение скорости синтеза ферментов и других белков или изменение их активности (см. модуль 4). Мишенью для гормона могут служить клетки одной или нескольких тканей. Воздействуя на клетку-мишень, гормон вызывает специфическую ответную реакцию, проявление которой зависит от того, какие метаболические пути активируются или тормозятся в этой клетке. Например, щитовидная железа - специфическая мишень для тиреотропина, под действием которого увеличивается количество ацинарных клеток щитовидной железы, повышается скорость биосинтеза тиреоидных гормонов. Глюкагон, воздействуя на адипоциты, активирует липолиз, в печени стимулирует мобилизацию гликогена и глюконеогенез.
Рецепторы гормонов могут быть расположены или в плазматической мембране или внутри клетки (в цитозоле или ядре).
По механизму действия гормоны можно разделить на две группы:
К первой группе относятся гормоны, взаимодействующие с мембранными рецепторами (пептидные гормоны, адреналин, а также гормоны местного действия - цитокины, эйкозаноиды);
- вторая группа включает гормоны, взаимодействующие с внутриклеточными рецепторами - стероидные гормоны, тироксин (см. модуль 4).
Связывание гормона (первичного мессенджера) с рецептором приводит к изменению конформации рецептора. Эти изменения улавливается другими макромолекулами, т.е. связывание гормона с рецептором приводит к сопряжению одних молекул с другими (трансдукция сигнала). Таким образом, генерируется сигнал, который регулирует клеточный ответ. В зависимости от способа передачи гормонального сигнала скорость реакций метаболизма в клетках меняется:
В результате изменения активности ферментов;
В результате изменения количества ферментов (рис. 11.2).
 Рис. 11.2. Основные этапы передачи гормональных сигналов в клетки-мишени
Рис. 11.2. Основные этапы передачи гормональных сигналов в клетки-мишени
ТЕМА 11.3. СТРОЕНИЕ И БИОСИНТЕЗ ГОРМОНОВ
1. Пептидные гормоны синтезируются, как и другие белки, в процессе трансляции из аминокислот. Некоторые пептидные гормоны - это короткие пептиды; например, гормон гипоталамуса тиреотропин - либерин - трипептид. Большинство гормонов передней доли гипофиза - гликопротеины.
Некоторые пептидные гормоны являются продуктами общего гена (рис. 11.3). Большинство полипептидных гормонов синтезируется в виде неактивных предшественников - препрогормонов. Образование активных гормонов происходит путем частичного протеолиза.
2. Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками. Молекула инсулина содержит также внутримолекулярный дисульфидный мостик в А-цепи.
Биосинтез инсулина начинается с образования неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с эндоплазматическим ретикулумом. Сигнальный
 Рис. 11.3. Образование пептидных гормонов, являющихся продуктами общего гена:
Рис. 11.3. Образование пептидных гормонов, являющихся продуктами общего гена:
А - ПОМК (проопиомеланокортин) синтезируется в передней и промежуточной долях гипофиза и в некоторых других тканях (кишечнике, плаценте). Полипептидная цепь состоит из 265 аминокислотных остатков; Б - после отщепления N-концевого сигнального пептида полипептидная цепь расщепляется на два фрагмента: АКТГ (39 а.к.) и β-липотропин (42-134 а.к.); В, Г, Д - при дальнейшем протеолизе происходит образование α- и β-МСГ (Меланоцитстимулирующего гормона) и эндорфинов. КППДГ - кортикотропиноподобный гормон промежуточной доли гипофиза. Процессинг ПОМК в передней и промежуточной долях гипофиза протекает по-разному, с образованием разного набора пептидов
пептид проникает в просвет эндоплазматического ретикулума и направляет в ЭР растущую полипептидную цепь. После окончания синтеза препроинсулина сигнальный пептид отщепляется (рис. 11.4).
Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка. Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Период полураспада инсулина в плазме крови составляет 3-10 минут, С-пептида - около 30 минут. Деградация инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени - в почках.
Главным стимулятором синтеза и секреции инсулина является глюкоза. Секреция инсулина усиливается также некоторыми аминокислотами (особенно аргинином и лизином), кетоновыми телами и жирными кислотами. Адреналин, соматостатин и некоторые пептиды ЖКТ тормозят секрецию инсулина.
 Рис. 11.4. Схема биосинтеза инсулина в клетках поджелудочной железы:
Рис. 11.4. Схема биосинтеза инсулина в клетках поджелудочной железы:
1 - синтез полипептидной цепи проинсулина; 2 - синтез происходит на полирибосомах, прикрепленных к наружной поверхности мембраны ЭР; 3 - сигнальный пептид отщепляется о завершении синтеза полипептидной цепи и образуется проинсулин; 4 - проинсулин транспортируется из ЭР в аппарат Гольджи и расщепляется на инсулин и С-пептид; 5 - инсулин и С-пептид включаются в секреторные гранулы и выделяются путем экзоцитоза (6); ЭР - эндоплазматический ретикулум; N - концевая часть молекулы;
3. Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков Лангерганса из неактивного предшественника препроглюкагона, который в результате частичного протеолиза превращается в активный гормон. Глюкоза и инсулин подавляют секрецию глюкагона; многие соединения, включая аминокислоты, жирные кислоты, нейромедиаторы (адреналин), ее стимулируют. Период полураспада гормона составляет ~5 минут. В печени глюкагон быстро разрушается под действием специфических протеаз.
4. Соматотропин синтезируется в виде прогормона в соматотрофных клетках, которые являются наиболее многочисленными в передней доле гипофиза. Гормон роста у всех видов млекопитающих представляет собой одноцепо-
чечный пептид с молекулярной массой 22 кД, состоящий из 191 аминокислотного остатка и имеющий две внутримолекулярные дисульфидные связи. Секреция гормона роста носит пульсирующий характер с интервалами в 20-30 минут. Один из самых больших пиков отмечается вскоре после засыпания. Под влиянием различных стимулов (физические упражнения, голодание, белковая пища, аминокислота аргинин) даже у нерастущих взрослых людей уровень гормона роста в крови может возрастать до 30-100 нг/мл. Регуляция синтеза и секреции гормона роста осуществляется множеством факторов. Основной стимулирующий эффект оказывает соматолиберин, основной тормозящий - гипоталамический соматостатин.
5. Иодтиронины синтезируются в составе белка - тиреоглобулина (Тг)
 Рис. 11.5. Синтез йодтиронинов:
Рис. 11.5. Синтез йодтиронинов:
ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - тиреоглобулин; Т 3 - трийодтиронин, Т 4 - тироксин. Тиреоглобулин синтезируется на рибосомах, далее поступает в комплекс Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит иодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт иода в клетки щитовидной железы, окисление йода, йодирование остатков тирозина, образование йодтиронинов, транспорт йодтиронинов в кровь
Тиреоглобулин - гликопротеин, содержит 115 остатков тирозина, синтезируется в базальной части клетки и хранится во внеклеточном коллоиде, где происходит йодирование остатков тирозина и образование йодтиронинов.
Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием моноиодтиронинов (МИТ) и дийодтиронинов (ДИТ). Две молекулы ДИТ конденсируются с образованием Т 4 , а МИТ и ДИТ - с образованием Т 3 . Йодтиреоглобулин транспортируется в клетку путем эндоцитоза и гидролизуется ферментами лизосом с освобождением Т 3 и Т 4 (рис. 11.6).
 Рис. 11.6. Структура гормонов щитовидной железы
Рис. 11.6. Структура гормонов щитовидной железы
Т 3 является основной биологически активной формой йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т 4 . В периферических тканях в результате дейодирования части Т 4 по пятому углеродному атому образуется так называемая «реверсивная» форма Т 3 , которая почти полностью лишена биологической активности
В крови йодтиронины находятся в связанной форме в комплексе с тироксинсвязывающим белком. Только 0,03% Т 4 и 0,3% Т 3 находятся в свободном состоянии. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Транспортные белки служат своеобразным депо, которое может обеспечить дополнительное количество свободных гормонов. Синтез и секреция иодтиронинов регулируется гипоталамо-гипофизарной системой
 Рис. 11.7. Регуляция синтеза и секреции йодтиронинов:
Рис. 11.7. Регуляция синтеза и секреции йодтиронинов:
1 - тиреотропин-либерин стимулирует освобождение ТТГ; 2 - ТТГ стимулирует синтез и секрецию йодтиронинов; 3, 4 - иодтиронины тормозят синтез и секрецию ТТГ
Йодтиронины регулируют процессы двух типов:
Рост и дифференцировку тканей;
Энергетический обмен.
6. Кортикостероиды. Общим предшественником всех кортикостероидов является холестерол. Источником холестерола для синтеза кортикостероидов служат его эфиры, поступающие в клетку в составе ЛПНП или депонированные в клетке. Освобождение холестерола из его эфиров и синтез кортикостероидов стимулируются кортикотропином. Реакции синтеза кортизола происходят в разных компартментах клеток коры надпочечников (см. рис. 11.12). При синтезе кортикостероидов образуется более 40 метаболитов, различающихся по структуре и биологической активности. Основными кортикостероидами, обладающими выраженной гормональной активностью, являются кортизол - главный представитель группы глюкокортикоидов, альдостерон - основной минералокортикоид и андрогены.
На первом этапе синтеза кортикостероидов происходит превращение холестерола в прегненолон путем отщепления 6-углеродного фрагмента от боковой цепи холестерола и окисления углеродного атома С 20 . Прегненолон превращается в прогестерон - С 21 предшественник стероидов - кортизола и альдостерона - и стероиды С 19 - предшественники андрогенов. Каким именно стероидом окажется конечный продукт, зависит от набора ферментов в клетке и последовательности реакций гидроксилирования (рис. 11.8).
 Рис. 11.8. Синтез основных кортикостероидов:
Рис. 11.8. Синтез основных кортикостероидов:
1 - превращение холестерола в прегненолон; 2 - образование прогестерона;
3 -гидроксилирование прогестерона (17-21-11) и образование кортизола;
4 - гидроксилирование прогестерона (21-11) и образование альдостерона;
5 - путь синтеза андрогенов
Первичное гидроксилирование прогестерона 17-гидроксилазой, а затем 21- и 11-гидроксилазой приводит к синтезу кортизола. Реакции образования альдостерона включают гидроксилирование прогестерона сначала 21-гид- роксилазой, а затем 11-гидроксилазой (см. рис. 11.8). Скорость синтеза и секреции кортизола регулируется гипоталамо-гипофизарной системой по механизму обратной отрицательной связи (рис. 11.9).
Стероидные гормоны транспортируются кровью в комплексе со специфическими транспортными белками.
Катаболизм гормонов коры надпочечников происходит прежде всего в печени. Здесь протекают реакции гидроксилирования, окисления и
 Рис. 11.9. Регуляция синтеза и секреции кортизола:
Рис. 11.9. Регуляция синтеза и секреции кортизола:
1 - стимуляция синтеза кортикотропин-либерина; 2 - кортикотропинлиберин стимулирует синтез и секрецию АКТГ; 3 - АКТГ стимулирует синтез и секрецию кортизола; 4 - кортизол тормозит секрецию АКТГ и кортиколиберина
восстановления гормонов. Продукты катаболизма кортикостероидов (кроме кортикостерона и альдостерона) выводятся с мочой в форме 17-кетостероидов. Эти продукты метаболизма выделяются преимущественно в виде конъюгатов с глюкуроновой и серной кислотами. У мужчин 2/3 кетостероидов образуется за счет кортикостероидов и 1/3 - за счет тестостерона (всего 12-17 мг в сутки). У женщин 17-кетостероиды образуются преимущественно за счет кортикостероидов (7-12 мг в сутки).
ТЕМА 11.4. РЕГУЛЯЦИЯ ОБМЕНА ОСНОВНЫХ ЭНЕРГОНОСИТЕЛЕЙ ПРИ НОРМАЛЬНОМ РИТМЕ
ПИТАНИЯ
1. Энергетическая ценность основных пищевых веществ выражается в килокалориях и составляет: для углеводов - 4 ккал/г, для жиров - 9 ккал/г, для белков - 4 ккал/г. Взрослому здоровому человеку в сутки требуется 2000- 3000 ккал (8000-12 000 кДж) энергии.
При обычном ритме питания промежутки между приемами пищи составляют 4-5 часов с 8-12-часовым ночным перерывом. В течение пищеварения и абсорбтивного периода (2-4 часа) основные энергоносители, используемые тканями (глюкоза, жирные кислоты, аминокислоты), могут поступать в кровь непосредственно из пищеварительного тракта. В постабсорбтивном периоде (промежуток времени после завершения пищеварения до следующего приема пищи) и при голодании энергетические субстраты образуются
в процессе катаболизма депонированных энергоносителей. Основную роль в регуляции этих процессов играют инсулин и глюкагон. Антагонистами инсулина являются также адреналин, кортизол, иодтиронины и соматотропин
(так называемые контринсулярные гормоны).
Инсулин и контринсулярные гормоны обеспечивают баланс между потребностями и возможностями организма в получении энергии, необходимой для нормального функционирования и роста. Этот баланс определяется как энергетический гомеостаз. При нормальном ритме питания концентрация глюкозы в крови поддерживается на уровне 65-110 мг/дл (3,58-6,05 ммоль/л) благодаря влиянию двух основных гормонов - инсулина и глюкагона. Инсулин и глюкагон - главные регуляторы метаболизма при смене состояний пищеварения, постабсорбтивного периода и голодания. На периоды пищеварения приходится 10-15 час в сутки, а расход энергии происходит в течение 24 часов. Поэтому часть энергоносителей во время пищеварения запасается для использования в постабсорбтивном периоде.
Печень, жировая ткань и мышцы - главные органы, обеспечивающие изменения метаболизма в соответствии с ритмом питания. Режим запасания включается после приема пищи и сменяется режимом мобилизации запасов после завершения абсорбтивного периода.
2. Изменения метаболизма основных энергоносителей в абсорбтивном периоде обусловлены, в основном, высоким инсулин-глюкагоновым индексом
(рис. 11.10).
В печени увеличивается потребление глюкозы, что является следствием ускорения метаболических путей, в которых глюкоза превращается в депонируемые формы энергоносителей: гликоген и жиры.
При повышении концентрации глюкозы в гепатоцитах происходит активация глюкокиназы, превращающей глюкозу в глюкозо-6-фосфат. Кроме этого, инсулин индуцирует синтез мРНК глюкокиназы. В результате повышается концентрация глюкозо-6-фосфата в гепатоцитах, что обусловливает ускорение синтеза гликогена. Этому также способствует одновременная инактивация гликогенфосфорилазы и активация гликогенсинтазы. Под влиянием инсулина в гепатоцитах ускоряется гликолиз в результате повышения активности и количества ключевых ферментов: глюкокиназы, фосфофруктокиназы и пируваткиназы. В то же время происходит торможение глюконеогенеза в результате инактивации фруктозо-1,6-бисфосфатазы и репрессии инсулином синтеза фосфоенолпируваткарбоксикиназы - ключевых ферментов глюконеогенеза (см. модуль 6).
Повышение концентрации глюкозо-6-фосфата в гепатоцитах в абсорбтивном периоде сочетается с активным использованием NADPH для синтеза жирных кислот, что способствует стимуляции пентозофосфатного пути.
Ускорение синтеза жирных кислот обеспечивается доступностью субстратов (ацетил-КоА и NADPH), образующихся при метаболизме глюкозы, а также активацией и индукцией ключевых ферментов синтеза жирных кислот инсулином.
 Рис. 11.10. Пути использования основных энергоносителей в абсорбтивном периоде:
Рис. 11.10. Пути использования основных энергоносителей в абсорбтивном периоде:
1 - биосинтез гликогена в печени; 2 - гликолиз; 3 - биосинтез ТАГ в печени; 4 - биосинтез ТАГ в жировой ткани; 5 - биосинтез гликогена в мышцах; 6 - биосинтез белков в разных тканях, в том числе в печени; ЖК - жирные кислоты
Аминокислоты, поступающие в печень из пищеварительного тракта, используются для синтеза белков и других азотсодержащих соединений, а их излишек либо поступает в кровь и транспортируется в другие ткани, либо дезаминируется с последующим включением безазотистых остатков в общий путь катаболизма (см. модуль 9).
Изменения метаболизма в адипоцитах. Основная функция жировой ткани - запасание энергоносителей в форме триацилглицеролов. транспорт глюкозы в адипоциты. Повышение внутриклеточной концентрации глюкозы и активация ключевых ферментов гликолиза обеспечивают образование ацетил-КоА и глицерол-3-фосфата, необходимых для синтеза ТАГ. Стимуляция пентозофосфатного пути обеспечивает образование NADPH, необходимого для синтеза жирных кислот. Однако биосинтез жирных кислот de novo в жировой ткани человека протекает с высокой скоростью только после предшествующего голодания. При нормальном ритме питания для синтеза ТАГ используются в основном жирные кислоты, поступающие из хиломикронов и ЛПОНП под действием ЛП-липазы (см. модуль 8).
Так как гормончувствительная ТАГ-липаза в абсорбтивном состоянии находится в дефосфорилированной, неактивной форме, процесс липолиза тормозится.
Изменение метаболизма в мышцах. Под влиянием инсулина ускоряется транспорт глюкозы в клетки мышечной ткани. Глюкоза фосфорилируется и окисляется для обеспечения клеток энергией, а также используется для синтеза гликогена. Жирные кислоты, поступающие из хиломикронов и ЛПОНП, в этот период играют незначительную роль в энергетическом обмене мышц. Поток аминокислот в мышцы и биосинтез белков также возрастает под влиянием инсулина, особенно после приема белковой пищи и в период мышечной работы.
3. Изменения метаболизма основных энергоносителей при смене абсорбтивного состояния на постабсорбтивное. В постабсорбтивном периоде при снижении инсулин-глюкагонового индекса изменения метаболизма направлены главным образом на поддержание концентрации в крови глюкозы, которая служит главным энергетическим субстратом для мозга и единственным источником энергии для эритроцитов. Основные изменения метаболизма в этот период происходят в печени и жировой ткани (рис. 11.11) и направлены на пополнение глюкозы за счет внутренних резервов и на использование других энергетических субстратов (жиров и аминокислот).
Изменения метаболизма в печени. Под влиянием глюкагона ускоряется мобилизация гликогена (см. модуль 6). Запасы гликогена в печени истощаются в течение 18-24-часового голодания. Главным источником глюкозы по мере исчерпания запасов гликогена становится глюконеогенез, который начинает ускоряться через 4-6 часов после последнего приема пищи. Субстратами для синтеза глюкозы служат лактат, глицерол и аминокислоты. Скорость синтеза жирных кислот снижается вследствие фосфорилирования и инактивации ацетил-КоА-карбоксилазы при фосфорилировании, а скорость β-окисления возрастает. Вместе с тем увеличивается снабжение печени жирными кислотами, которые транспортируются из жировых депо в результате ускорения липолиза. Ацетил-КоА, образующийся при окислении жирных кислот, используется в печени для синтеза кетоновых тел.
В жировой ткани с нижается скорость синтеза ТАГ и стимулируется липолиз. Стимуляция липолиза является результатом активации гормончувствительной ТАГ-липазы адипоцитов под влиянием глюкагона. Жирные кислоты становятся важными источниками энергиии в печени, мышцах и жировой ткани.
Таким образом, в постабсорбтивном периоде концентрация глюкозы в крови поддерживается на уровне 60-100 мг/дл (3,5-5,5 ммоль/л), а уровень жирных кислот и кетоновых тел возрастает.
 Рис. 11.11. Пути использования основных энергоносителей при смене абсорбтивного состояния на постабсорбтивное:
Рис. 11.11. Пути использования основных энергоносителей при смене абсорбтивного состояния на постабсорбтивное:
I - снижение инсулин-глюкагонового индекса; 2 - распад гликогена; 3, 4 - транспорт глюкозы в мозг и эритроциты; 5 - катаболизм жиров; 6 - транспорт жиров в печень и мышцы; 7 - синтез кетоновых тел в печени; 8 - транспорт кетоновых тел в мышцы; 9 - глюконеогенез из аминокислот; 10 - синтез и выведение мочевины;
II - транспорт лактата в печень и включение в глюконеогенез; 12 - глюконеогенез из глицерола; КТ -кетоновые тела; ЖК - жирные кислоты
ТЕМА 11.5. ИЗМЕНЕНИЯ МЕТАБОЛИЗМА ПРИ ГИПО- И ГИПЕРСЕКРЕЦИИ ГОРМОНОВ
Изменение скорости синтеза и секреции гормонов может происходить не только как адаптационный процесс, возникающий в ответ на изменение физиологической активности организма, но часто является результатом нарушений функциональной активности эндокринных желез при развитии в них патологических процессов или нарушений регуляции. Эти нарушения могут проявляться либо в форме гипофункции, приводящей к снижению количества гормона, либо гиперфункции, сопровождающейся избыточным его синтезом.
1. Гиперфункция щитовидной железы (гипертиреоз) проявляется в нескольких клинических формах. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - наиболее распространенное заболевание щитовидной железы. При этом заболевании отмечается увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2-5 раз и развитие тиреотоксикоза.
Характерными признаками тиреотоксикоза являются увеличение основного обмена, учащение сердцебиений, мышечная слабость, потеря массы тела (несмотря на повышенный аппетит), потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и катаболических процессов (катаболизм углеводов, липидов и беков). В большей мере усиливаются процессы катаболизма, о чем свидетельствует отрицательный азотистый баланс. Гипертиреоз может возникать в результате различных причин: развития опухоли, воспаления (тиреоидит), избыточного поступления йода и йодсодержащих препаратов, аутоиммунных реакций.
Аутоиммунный гипертиреоз возникает в результате образования антител к рецепторам тиреотропного гормона в щитовидной железе. Один из них - иммуноглобулин (IgG) - имитирует действие тиреотропина, взаимодействуя с рецепторами ТТГ на мембране клеток щитовидной железы. Это приводит к диффузному разрастанию щитовидной железы и избыточной неконтролируемой продукции Т 3 и Т 4 , поскольку образование IgG не регулируется по механизму обратной связи. Уровень ТТГ при этом заболевании снижен вследствие подавления функции гипофиза высокими концентрациями йодтиронинов.
2. Гипотиреоз может быть результатом недостаточного поступления йода в организм - эндемического зоба. Реже гипотиреоз возникает в результате врожденных дефектов ферментов, участвующих в синтезе (например, тиреопероксиразы) йодтиронинов, или как осложнение других болезней, при которых повреждаются гипоталамус, гипофиз или щитовидная железа. При некоторых формах гипотиреоза в крови обнаруживаются антитела к тиреоглобулину. Гипофункция щитовидной железы в раннем детском возрасте приводит к задержке физического и умственного развития - кретинизм. У взрослых гипофункция проявляется как микседему (слизистый отек). Главным проявлением микседемы является избыточное накопление в коже протеогликанов и воды. Основные симптомы гипотиреоза: сонливость, снижение толерантности к холоду, увеличение массы тела, снижение температуры тела.
3. Гиперкортицизм. Избыточное образование кортикостероидов, главным образом кортизола, - гиперкортицизм - часто является результатом нарушения регуляторных механизмов синтеза кортизола:
При опухоли гипофиза и повышенной продукции кортикотропина (болезнь Иценко-Кушинга);
При опухолях надпочечников, продуцирующих кортизол (синдром Иценко-Кушинга).
Главные проявления гиперкортицизма: гиперглюкоземия и снижение толерантности к глюкозе вследствие стимуляции глюконеогенеза и гипертензия как результат проявления минералокортикоидной активности кортизола и повышения концентрации ионов Na+.
4. Гипокортицизм. Наследственная адреногенитальная дистрофия в 95% случаев является следствием дефицита 21-гидроксилазы (см. рис. 11.8). При этом увеличивается образование 17-ОН прогестерона и продукции андрогенов. Характерными симптомами заболевания являются раннее половое созревание у мальчиков и развитие мужских половых признаков у девочек. При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл.
Приобретенная недостаточность надпочечников может развиваться в результате туберкулезного или аутоиммунного повреждения клеток коры надпочечников и снижения синтеза кортикостероидов. Потеря регуляторного контроля со стороны надпочечников приводит к повышению секреции кортикотропина. В этих случаях у больных отмечается усиление пигментации кожи и слизистых (аддисонова болезнь), что обусловлено повышенной продукцией кортикотропина и других производных ПОМК, в частности меланоцитстимулирующего гормона (см. рис. 11.3). Основные клинические проявления надпочечниковой недостаточности: гипотензия, мышечная слабость, гипонатриемия, потеря массы тела, непереносимость стресса.
Недостаточность функции коры надпочечников часто является следствием длительного применения кортикостероидных препаратов, подавляющих синтез кортикотропина по механизму обратной связи. Отсутствие стимулирующих сигналов приводит к атрофии клеток коры надпочечников. При резкой отмене гормональных препаратов может развиться острая надпочечниковая недостаточность (так называемый синдром «отмены»), которая представляет большую угрозу для жизни, так как сопровождается декомпенсацией всех видов обмена и процессов адаптации. Она проявляется сосудистым коллапсом, резкой адинамией, потерей сознания. Такое состояние возникает вследствие нарушения обмена электролитов, которое приводит к потере ионов Na+ и С1 - с мочой и обезвоживанию за счет потери внеклеточной жидкости. Изменение углеводного обмена проявляется в снижении уровня сахара в крови, уменьшении запаса гликогена в печени и скелетных мышцах.
1. Перенесите в тетрадь и заполните табл. 11.1.
Таблица 11.1. Инсулин и основные контринсулярные гормоны
2. Используя рис. 11.4, выпишите этапы синтеза инсулина. Объясните, какие причины могут привести к развитию инсулиновой недостаточности? Почему в этих случаях с целью диагностики можно определять в крови концентрацию С-пептида?
3. Изучите схему синтеза йодтиронинов (рис. 11.5). Опишите основные этапы их синтеза и нарисуйте схему регуляции синтеза и секреции тиреоидных гормонов. Объясните основные проявления гипо- и гипертиреоза. Почему при применении тироксина как лекарства необходим постоянный контроль уровня ТТГ в крови?
4. Изучите последовательность этапов синтеза кортизола (рис. 11.8). Найдите на схеме этапы, катализируемые ферментами, дефект которых является причиной возникновения адреногенитального синдрома.
5. Опишите схему внутриклеточного цикла синтеза кортизола начиная с взаимодействия АКТГ с рецептором (рис. 11.12), заменив цифры названиями участвующих в них белков.
6. Нарисуйте схему регуляции синтеза и секреции кортикостероидов. Объясните причины и проявления синдрома отмены стероидных препаратов.
7. Опишите последовательность событий, которые приводят к повышению концентрации глюкозы в крови в течение первого часа после приема пищи и ее последующему возвращению к исходному уровню в течение 2 часов (рис. 11.13). Объясните роль гормонов в этих событиях.
8. Проанализируйте изменения гормонального статуса и метаболизма в печени, жировой ткани и мышцах в абсорбтивном (рис. 11.10) и постабсорбтивном периодах (рис. 11.11). Назовите процессы, обозначенные цифрами. Укажите регуляторные ферменты и механизм изменения их активности, учитывая, что первичным сигналом для стимуляции этих процессов является изменение концентрации глюкозы в крови и реципрокные изменения концентрации инсулина и глюкагона (рис. 11.11).
 Рис. 11.12. Внутриклеточный цикл синтеза кортизола:
Рис. 11.12. Внутриклеточный цикл синтеза кортизола:
ЭХС - эфиры холестерола; ХС - холестерол
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы. Гормоны:
A. Проявляют свои эффекты через взаимодействие с рецепторами Б. Синтезируются в задней доле гипофиза
B. Измененяют активность ферментов путем частичного протеолиза Г. Индуцируют синтез ферментов в клетках-мишенях
Д. Синтез и секреция регулируется по механизму обратной связи
 Рис. 11.13. Динамика изменений концентрации глюкозы (А), инсулина (Б) и глюкагона (В) после приема пищи, богатой углеводами
Рис. 11.13. Динамика изменений концентрации глюкозы (А), инсулина (Б) и глюкагона (В) после приема пищи, богатой углеводами
2. Выберите правильный ответ. Глюкагон в жировой ткани активирует:
A. Гормончувствительную ТАГ-липазу Б. Глюкозо-6-фосфатдегидрогеназу
B. Ацетил-КоА-карбоксилазу Г. ЛП-липазу
Д. Пируваткиназу
3. Выберите правильные ответы. Йодтиронины:
A. Синтезируются в гипофизе
Б. Взаимодействуют с внутриклеточными рецепторами
B. Стимулируют работу Na, Ka-АТФазы
Г. В высоких концентрациях ускоряют процессы катаболизма Д. Участвуют в ответной реакции на охлаждение
4. Установите соответствие:
A. Базедова болезнь Б. Микседема
B. Эндемический зоб Г. Кретинизм
Д. Аутоиммунный тиреоидит
1. Возникает при гипофункции щитовидной железы в раннем возрасте
2. Сопровождается накоплением протеогликанов и воды в коже
3. Является следствием образования иммуноглобулина, имитирующего действие ТТГ
5. Выберите правильные ответы.
Для абсорбтивного периода характерно:
A. Повышение концентрации инсулина в крови Б. Ускорение синтеза жиров в печени
B. Ускорение глюконеогенеза
Г. Ускорение гликолиза в печени
Д. Повышение концентрации глюкагона в крови
6. Выберите правильные ответы.
Под влиянием инсулина в печени ускоряются:
A. Биосинтез белков
Б. Биосинтез гликогена
B. Глюконеогенез
Г. Биосинтез жирных кислот Д. Гликолиз
7. Установите соответствие. Гормон:
A. Инсулин Б. Глюкагон
B. Кортизол Г. Адреналин
Функция:
1. Стимулирует синтез жиров из глюкозы в печени
2. Стимулирует мобилизацию гликогена в мышцах
3. Стимулирует синтез йодтиронинов
8. Выберите правильные ответы. Стероидные гормоны:
A. Проникают в клетки-мишени
Б. Транспортируются кровью в комплексе со специфическими белками
B. Стимулируют реакции фосфорилирования белков
Г. Взаимодействуют с хроматином и изменяют скорость транскрипции Д. Участвуют в процессе трансляции.
9. Выберите правильные ответы. Инсулин:
A. Ускоряет транспорт глюкозы в мышцы Б. Ускоряет синтез гликогена в печени
B. Стимулирует липолиз в жировой ткани Г. Ускоряет глюконеогенез
Д. Ускоряет транспорт глюкозы в адипоциты
1. А, Г, Д 6. А, Б, Г, Д
2. А 7. 1-А, 2-Г, 3-Д
3. Б, В, Г, Д 8. А, Б, Г
4. 1-Г, 2-Б, 3 - А 9. А, Б, Д
5. А, Б, Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
2. Препрогормон
3. Стимулы для синтеза и секреции
4. Клетки-мишени
5. Рецепоры
6. Иерархия регуляторных систем
7. Аутокринный механизм действия
8. Паракринный механизм действия
9. Гомеостаз
10. Абсорбтивный период
11. Постабсорбтивный период
12. Адаптация
13. Гипофункция
14. Гиперфункия
15. Контринсулярные гормоны
Решите задачи
1. При обследовании больных с явлениями гиперкортицизма используют функциональную пробу с «нагрузкой» дексаметазоном (дексаметазон - структурный аналог кортизола). Как изменится концентрация 17-кетостероидов в моче пациентов после введения дексаметазона, если причиной гиперкортицизма является:
а) гиперпродукция кортикотропина;
б) гормонально активная опухоль надпочечников.
2. Родители пятилетней девочки обратились в медицинский центр для консультации. При обследовании у ребенка отмечены проявления вторичных мужских половых признаков: гипертрофия мышц, избыточное оволосенение, снижение тембра голоса. В крови повышен уровень АКТГ. Врач диагностировал адреногенитальный синдром (врожденная дисфункция коры надпочечников). Обоснуйте диагноз врача. Для этого:
а) представьте схему синтеза стероидных гормонов; назовите основные физиологически активные кортикостероиды и укажите их функции;
б) назовите ферменты, недостаточность которых является причиной описанных выше симптомов;
в) укажите образование каких продуктов синтеза кортикостероидов увеличивается при этой патологии;
г) объясните, почему у ребенка в крови повышена концентрация АКТГ.
3. Одна из форм болезни Аддисона является следствием атрофии клеток коры надпочечников при длительном лечении кортикостероидными препаратами. Основные проявления болезни: мышечная слабость, гипоглюкоземия,
дистрофические изменения в мышцах, снижение артериального давления; в ряде случаев у таких больных отмечается усиление пигментации кожи и слизистых. Как объяснить перечисленные симптомы заболевания? Для объяснения:
а) представьте схему синтеза стероидных гормонов; назовите основные физиологически активные кортикостероиды и укажите их функции;
б) укажите, дефицит каких кортикостероидов является причиной гипоглюкоземии и мышечной дистрофии при этом заболевании;
в) назовите причину повышенной пигментации кожи при болезни Аддисона.
4. Пациенту N с гипотиреозом врач назначил лечение, включающее прием тироксина. Спустя 3 месяца после начала лечения уровень ТТГ в крови снизился незначительно. Почему этому больному врач рекомендовал увеличить дозу тироксина? Для ответа:
а) представьте в виде схемы механизм регуляции синтеза и секреции тиреоидных гормонов;
5. Девушка 18-лет живущая в горном селении, обратилась к эндокринологу с жалобами на общую слабость, снижение температуры тела, ухудшение настроения. Пациентка была направлена на анализ крови на ТТГ и йодтиронины. Результаты анализа показали повышение коцентрации ТТГ и снижение концентрации Т 4. . Объясните:
а) какое заболевание можно предположить у пациентки;
б) что может быть причиной такой патологии;
в) есть ли связь между местом проживания и возникновением данного заболевания;
г) какую диету следует соблюдать в целях профилактики этой патологии;
д) схему регуляции синтеза йодтиронинов и результаты анализа крови у обследуемой.
6. Для лечения диффузного токсического зоба применяют тиреостатические препараты группы тионамидов (тиамазол). Механизм действия тионамидов заключается в том, что, попадая в щитовидную железу, они подавляют активность тиреопероксидазы. Объясните результат лечебного действия тионамидов. Для этого:
а) назовите основные причины и клинические проявления тиреотоксикоза;
б) приведите схему синтеза йодтиронинов и укажите этапы, на которые действуют лекарства;
в) укажите, как изменится концентрация йодтиронинов и ТТГ в результате лечения;
г) опишите изменения метаболизма при лечении тионамидами.
Модульная единица 2 БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ ОБМЕНА ВЕЩЕСТВ ПРИ ГОЛОДАНИИ И САХАРНОМ ДИАБЕТЕ
Цели изучения Уметь:
1. Интерпретировать изменения в метаболизме углеводов, жиров и белков при голодании и физической нагрузке как результат действия контринсулярных гормонов.
2. Анализировать молекулярные механизмы причин сахарного диабета.
3. Объяснять механизмы возникновения симптомов сахарного диабета как следствие изменений скоростей метаболических процессов.
4. Интерпретировать основные различия в обмене веществ при голодании и сахарном диабете.
Знать:
1. Изменения гормонального статуса при голодании.
2. Изменение обмена основных энергоносителей при голодании.
3. Изменение гормонального статуса и энергетического метаболизма при сахарном диабете.
4. Основные симптомы сахарного диабета и механизмы их возникновения.
5. Патогенез острых осложнений при диабете.
6. Биохимические основы поздних осложнений сахарного диабета.
7. Подходы к лабораторной диагностике сахарного диабета.
8. Молекулярные механизмы принципов лечения сахарного диабета и перспективные направления лечения.
ТЕМА 11.6. ИЗМЕНЕНИЯ ГОРМОНАЛЬНОГО СТАТУСА И МЕТАБОЛИЗМА ПРИ ГОЛОДАНИИ И ФИЗИЧЕСКОЙ РАБОТЕ
1. В постабсорбтивном периоде и голодании уровень глюкозы в плазме крови падает до нижней границы нормы. Отношение инсулин - глюкагон снижается. В этих условиях возникает состояние, для которого характерно преобладание процессов катаболизма жиров, гликогена и белков на фоне общего снижения скорости метаболизма. Под влиянием контринсулярных гормонов в этот период происходит обмен субстратами между печенью, жировой тканью, мышцами и мозгом. Этот обмен служит двум целям:
Поддержанию концентрации глюкозы в крови за счет глюконеогенеза для обеспечения глюкозозависимых тканей (мозга, эритроцитов);
Мобилизации других «топливных» молекул, в первую очередь жиров, для обеспечения энергией всех других тканей.
Проявление этих изменений позволяет условно выделить три фазы голодания. Вследствие переключения метаболизма на режим мобилизации энергоносителей даже после 5-6 недель голодания концентрация глюкозы в крови составляет не менее 65 мг/дл. Основные изменения при голодании происходят в печени, жировой ткани и мышцах (рис. 11.14).
2. Фазы голодания. Голодание может быть кратковременным - в течение суток (первая фаза), продолжаться в течение недели (вторая фаза) или нескольких недель (третья фаза).
В первую фазу концентрация инсулина в крови снижается примерно в 10-15 раз по сравнению с периодом пищеварения, а концентрация глюкагона и кортизола увеличивается. Запасы гликогена исчерпываются, нарастает скорость мобилизации жиров и скорость глюконеогенеза из аминокислот и глицерола, концентрация глюкозы в крови снижается до нижней границы нормы (60 мг/дл).
 Рис. 11.14. Изменения метаболизма основных энергоносителей при голодании:
Рис. 11.14. Изменения метаболизма основных энергоносителей при голодании:
1 - снижение инсулин-глюкогонового индекса; 2 - мобилизация гликогена; 3, 4 - транспорт ГЛК в мозг и эритроциты; 5 - мобилизация ТАГ; 6 - транспорт ЖК в мышцы; 7 - синтез кетоновых тел; 8 - транспорт ЖК в печени; 9 - транспорт АК в печень; 10 - глюконеогенез из АК; 11 - транспорт лактата в печень; 12 - транспорт глицерола в печень. Пунктиром обозначены процессы, скорость которых снижается
Во вторую фазу продолжается мобилизация жиров, концентрация жирных кислот в крови повышается, увеличивается скорость образования кетоновых тел в печени и, соответственно, их концентрация в крови; ощущается запах ацетона, который выделяется с выдыхаемым воздухом и потом от голодающего человека. Глюконеогенез продолжается за счет распада тканевых белков.
В третью фазу снижается скорость распада белков и скорость глюконеогенеза из аминокислот. Скорость метаболизма замедляется. Азотистый баланс во все фазы голодания отрицательный. Для мозга важным источником энергии, наряду с глюкозой, становятся кетоновые тела.
3. Изменения метаболизма основных энергоносителей при голодании. Обмен углеводов. Запасы гликогена в организме истощаются в течение 24-часового голодания. Таким образом, за счет мобилизации гликогена обеспечивается только кратковременное голодание. Основной процесс, обеспечивающий ткани глюкозой в период голодания, - глюконеогенез. Глюконеогенез начинает ускоряться через 4-6 часов после последнего приема пищи и становится единственным источником глюкозы в период длительного голодания. Основные субстраты глюконеогенеза - аминокислоты, глицерол и лактат.
4. Обмен жиров и кетоновых тел. Основным источником энергии в первые дни голодания становятся жирные кислоты, которые образуются из ТАГ в жировой ткани. В печени ускоряется синтез кетоновых тел. Синтез кетоновых тел начинается в первые дни голодания. Используются кетоновые тела в основном в мышцах. Энергетические потребности мозга частично обеспечиваются также кетоновыми телами. После 3 недель голодания в мышцах снижается скорость окисления кетоновых тел и мышцы почти исключительно используют жирные кислоты. Концентрация кетоновых тел в крови возрастает. Использование кетоновых тел мозгом продолжается, но становится менее активным из-за снижения скорости глюконеогенеза и снижения концентрации глюкозы.
5. Обмен белков. В течение нескольких первых дней голодания быстро распадаются мышечные белки - основной источник субстратов для глюконеогенеза. После нескольких недель голодания скорость глюконеогенеза из аминокислот снижается в основном вследствие снижения потребления глюкозы и использования кетоновых тел в мозге. Снижение скорости глюконеогенеза из аминокислот необходимо для сбережения белков, так как потеря 1/3 всех белков может привести к смерти. Продолжительность голодания зависит от того, как долго могут синтезироваться и использоваться кетоновые тела. Однако для окисления кетоновых тел необходим оксалоацетат и другие компоненты ЦТК. В норме они образуется из глюкозы и аминокислот, а при голодании только из аминокислот.
ТЕМА 11.7. ИЗМЕНЕНИЯ ГОРМОНАЛЬНОГО СТАТУСА И МЕТАБОЛИЗМА ПРИ САХАРНОМ ДИАБЕТЕ
1. Сахарный диабет возникает вследствие относительного или абсолютного дефицита инсулина. В соответствии с классификацией ВОЗ различают две основные формы заболевания: диабет I типа - инсулинзависимый (ИЗСД), и диабет II типа (ИНСД) - инсулиннезависимый.
2. ИЗСД является следствием разрушения β-клеток островков Лангерганса в результате аутоиммунных реакций. Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию β-клеток. К таким вирусам относятся вирусы оспы, краснухи, кори, цитомегаловирус, эпидимического паротита, вирус Коксаки, аденовирус. На долю ИЗСД приходится примерно 25-30% всех случаев диабета. Как правило, разрушение β-клеток происходит медленно и начало заболевания не сопровождается нарушениями метаболизма. Когда погибает 80-95% клеток, возникает абсолютный дефицит инсулина и развиваются тяжелые метаболические нарушения. ИЗСД поражает в большинстве случаев детей, подростков и молодых людей, но может проявиться в любом (начиная с годовалого) возрасте.
3. ИНСД развивается вследствие нарушения превращения проинсулина в инсулин, регуляции секреции инсулина, повышения скорости катаболизма инсулина, повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и т.д.), образование антител к рецепторам инсулина, причем концентрация инсулина в крови может быть нормальной или даже повышенной. К факторам, определяющим развитие и клиническое течение болезни, относятся ожирение, неправильный режим питания, малоподвижный образ жизни, стресс. ИНСД поражает людей, как правило, старше 40 лет, развивается постепенно, симптомы выражены умеренно. Острые осложнения бывают редко.
4. Изменения метаболизма при сахарном диабете. При сахарном диабете, как правило, соотношение инсулин - глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приема пищи функционируют в режиме постабсорбтивного состояния.
5. Симптомы сахарного диабета. Гиперглюкоземия. Для всех форм диабета характерно повышение концентрации глюкозы в крови - гиперглюкоземия, как после приема пищи, так и натощак, а также глюкозурия. После приема пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе.
Снижение толерантности к глюкозе наблюдается и в случаях скрытой (латентной) формы сахарного диабета. В этих случаях у людей отсутствуют жалобы и клинические симптомы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует верхней границе нормы. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе (рис. 11.15).
Повышение концентрации глюкозы при ИЗСД в плазме крови обусловлено несколькими причинами. При снижении инсулин-глюкагонового индекса усиливаются эффекты контринсулярных гормонов, уменьшается количество белков - переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). Следовательно, снижается потребление глюкозы этими клетками. В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, действие конринсулярных гормонов, в первую очередь глюкагона, активирует глюконеогенез из аминокислот, глицерола и лактата. Повышение уровня глюкозы в крови при сахарном диабете выше концентрационного почечного порога, равного 180 мг/дл, становится причиной выделения глюкозы с мочой.
Кетонемия является характерным признаком сахарного диабета. При низком соотношении инсулин - глюкагон жиры не депонируются, ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицированных жирных кислот в крови повышается. Печень захватывает жирные кислоты и окисляет их до ацетил-КоА, который в свою очередь
 Рис. 11.15. Изменение толерантности к глюкозе у больных скрытой формой сахарного диабета.
Рис. 11.15. Изменение толерантности к глюкозе у больных скрытой формой сахарного диабета.
Определение толерантности к глюкозе используют для диагностики сахарного диабета. Обследуемый принимает раствор глюкозы из расчета 1 г на 1 кг массы тела (сахарная нагрузка). Концентрацию глюкозы в крови измеряют в течение 2-3 часов с интервалами в 30 минут. 1 - у здорового человека, 2 - у больного сахарным диабетом
превращается в β-гидроксимасляную и ацетоуксусную кислоты, в результате чего в крови повышается концентрация кетоновых тел - кетонемия. В тканях ацетоацетат частично декарбоксируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную емкость крови и вызывает ацидоз (кетоацидоз).
Гиперлипопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания и низкой активности ЛП-липазы, а поступают в печень, где превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП.
Азотемия. При диабете дефицит инсулина приводит к снижению скорости синтеза и усилению распада белков в организме. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Безазотистые остатки гликогенных аминокислот включаются в глюконеогенез, что еще более усиливает гиперглюкоземию. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и соответственно в моче - азотемии и азотурии.
Полиурия. Для выведения большого количества глюкозы, кетоновых тел и мочевины требуется большой объем жидкости, в результате чего может наступить обезвоживание организма. Это объясняется особенностями концентрационной способности почек. Например, выделение мочи у больных возрастает в несколько раз и в некоторых случаях достигает 8-9 л в сутки, но чаще не превышает 3-4 л. Этот симптом называется полиурией. Потеря воды вызывает постоянную жажду и увеличение потребления воды - полидипсию.
6. Острые осложнения сахарного диабета. Механизмы развития диабетической комы. Нарушения обмена углеводов, жиров и белков при сахарном диабете могут приводить к развитию коматозных состояний (острые осложнения). Диабетическая кома проявляется как резкое нарушение всех функций организма, сопровождающееся потерей сознания. Основными предшественниками диабетической комы являются ацидоз и дегидратация тканей (рис. 11.16).
При декомпенсации диабета развивается нарушение водно-электролитного обмена. Причиной этого является гиперглюкоземия, сопровождающаяся повышением осмотического давления в сосудистом русле. Для сохранения осмолярности начинается компенсаторное перемещение жидкости из клеток и внеклеточного пространства в сосудистое русло. Это ведет к потере тканями воды и электролитов, прежде всего ионов Na+, K+, Cl - , HCO 3 - . В результате развиваются тяжелая клеточная дегидратация и дефицит внутриклеточных ионов (прежде всего К +), сопровождающаяся общей дегидратацией. Это приводит к снижению периферического кровообращения, уменьшению мозгового и почечного кровотока и гипоксии. Диабетическая кома развивается медленно, в течение нескольких дней, но иногда может
 Рис. 11.16. Изменения метаболизма при сахарном диабете и причины диабетической комы
Рис. 11.16. Изменения метаболизма при сахарном диабете и причины диабетической комы
возникнуть и в течение нескольких часов. Первыми признаками могут быть тошнота, рвота, заторможенность. Артериальное давление у больных снижено.
Коматозные состояния при сахарном диабете могут проявляться в трех основных формах: кетоацидотической, гиперосмолярной и лактоацидотической.
Для кетоацидотической комы характерны выраженный дефицит инсулина, кетоацидоз, полиурия, полидипсия. Гиперглюкоземия (20-30 ммоль/л), обусловленная инсулиновой недостаточностью, сопровождается большими потерями жидкости и электролитов, дегидратацией и гиперосмолярностью плазмы. Общая концентрация кетоновых тел достигает 100 мг/дл и выше.
При гиперосмолярной коме наблюдается чрезвычайно высокие уровни глюкозы в плазме крови, полиурия, полидипсия, всегда проявляется тяжелая дегидратация. Предполагают, что у большинства больных гиперглюкоземия обусловлена сопутствующим нарушением функции почек. Кетоновые тела в сыворотке крови обычно не определяются.
При лактоацидотической коме преобладающими являются гипотония, снижение периферического кровообращения, гипоксия тканей, приводящая к смещению метаболизма в сторону анаэробного гликолиза, что обусловливает повышение концентрации молочной кислоты в крови (лактоацидоз).
7. Поздние осложнения сахарного диабета являются следствием длительной гиперглюкоземии и часто приводят к ранней инвалидизации больных. Гиперглюкоземия приводит к повреждению кровеносных сосудов и нарушению функций различных тканей и органов. Одним из основных механизмов повреждения тканей при сахарном диабете является глюкозилирование белков и связанное с этим нарушение функции клеток тканей, изменение реологических свойств крови и гемодинамики (текучесть, вязкость).
Некоторые соединения в норме содержат углеводные компоненты (гликопротеины, протеогликаны, гликолипиды). Синтез этих соединений происходит в результате ферментативных реакций (ферментативное глюкозилирование). Однако в организме человека может происходить и неферментативное взаимодействие альдегидной группы глюкозы со свободными аминогруппами белков (неферментативное глюкозилирование). В тканях здоровых людей этот процесс протекает медленно, а при гиперглюкоземии ускоряется.
Одним из первых признаков диабета является увеличение в 2-3 раза глюкозилированного гемоглобина. На протяжении всего срока существования эритроцитов глюкоза свободно проникает через его мембрану и без участия ферментов необратимо связывается с гемоглобином, преимущественно β-цепями. При этом образуется глюкозилированная форма гемоглобина HbA 1c . Эта форма гемоглобина в небольшом количестве имеется и у здоровых людей. В условиях хронической гиперглюкоземии процент HbA 1c по отношению к общему количеству гемоглобина увеличивается.
Степень глюкозилирования белков зависит от скорости их обновления. В медленно обменивающихся белках накапливается больше изменений. К медленно обменивающимся белкам относятся белки межклеточного
матрикса, базальных мембран, хрусталика глаза (кристаллины). Утолщение базальных мембран - один из ранних и постоянных признаков сахарного диабета, проявляющихся в форме диабетических ангиопатий.
Изменения, проявляющиеся в снижении эластичности артерий, поражении крупных и средних сосудов мозга, сердца, нижних конечностей, называются диабетическими макроангиопатиями. Они развиваются вследствие глюкозилирования белков межклеточного матрикса - коллагена и эластина, что приводит к снижению эластичности сосудов и нарушению кровообращения.
Результат повреждения капилляров и мелких сосудов - микроангиопатии проявляются в форме нефро- и ретинопатии. Причиной некоторых поздних осложнений сахарного диабета (катаракты, ретинопатии) может быть повышение скорости превращения глюкозы в сорбитол. Сорбитол не используется в других метаболических путях, а скорость его диффузии из клеток невелика. У больных сахарным диабетом сорбитол накапливается в сетчатке и хрусталике глаза, клетках клубочков почек, шванновских клетках, в эндотелии. Сорбитол в высоких концентрациях токсичен для клеток. Его накопление в нейронах приводит к увеличению осмотического давления, набуханию клеток и отеку тканей. Помутнение хрусталика, или катаракта, может развиться как вследствие вызванного накоплением сорбитола набухания хрусталика и нарушения упорядоченной структуры кристаллинов, так и вследствие глюкозилирования кристаллинов, которые образуют многомолекулярные агрегаты, увеличивающие преломляющую способность хрусталика.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Рассмотрите рис. 11.14, изобразите схемы процессов, которые ускоряются в печени и других тканях при наступлении постабсорбтивного периода, выпишите названия метаболических путей и соответствующие регуляторные ферменты.
2. Проанализируйте изменения метаболизма, представленные на рис. 11.10 и 11.11 и сравните их с изменениями, изображенными на рис. 11.14. Для этого:
а) назовите процессы, которые активируются и ингибируются при длительном голодании;
б) выберите и напишите схемы процессов, за счет которых поддерживается концентрация глюкозы в крови при длительном голодании;
в) для каждого выбранного процесса укажите ключевые ферменты и гор-
моны, под влиянием которых происходит их активация;
г) выберите и напишите схемы процессов, за счет которых осуществляет-
ся энергообеспечение мышц при длительном голодании.
3. Изучите схему изменений метаболизма при сахарном диабете (рис. 11.16).Объяснитепричинывозникновениягиперглюкоземии.Выпишите названия метаболических путей, которые ускоряются в этих условиях.
4. Объясните причины и механизмы возникновения кетоацидоза при сахарном диабете и изобразите соответствующую схему.
5. Сравните изменения гормонального статуса и метаболизма при сахарном диабете и голодании (рис. 11.14 и 11.16). Объясните, почему на фоне гиперглюкоземии при сахарном диабете происходит катаболизм жиров и белков.
6. Перечислите основные симптомы сахарного диабета. Обоснуйте справедливость выражения: «сахарный диабет - это голод среди изобилия». Для этого:
а) назовите проявления сахарного диабета, сходные с изменениями обмена веществ при голодании;
б) объясните причины возникновения этих изменений;
в) назовите основные различия в обмене веществ при сахарном диабете и голодании.
7. Продолжите заполнение таблицы поздних осложнений сахарного диабета (табл. 11.2):
Таблица 11.2. Поздние осложнения сахарного диабета
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ.
При голодании:
A. Ацетил-КоА-карбоксилаза фосфорилирована и активна Б. Гормон-чувствительная ТАГ-липаза неактивна
B. ЛП-липаза в жировой ткани активна
Г. Пируваткиназа в печени фосфорилирована и активна Д. сАМР-зависимая протеинкиназа в адипоцитах активна
2. Выберите правильные ответы. При трехдневном голодании:
A. Инсулин-глюкагоновый индекс снижен
Б. Скорость глюконеогенеза из аминокислот увеличивается
B. Скорость синтеза ТАГ в печени снижается Г. Скорость β-окисления в печени снижается
Д. Концентрация кетоновых тел в крови выше нормы
3. Выберите правильные ответы.
Увеличение скорости синтеза кетоновых тел при голодании является следствием:
A. Снижения уровня глюкагона
Б. Снижения образования Ацетил-КоА в печени
B. Повышения концентрации жирных кислот в плазме крови Г. Снижения скорости β-окисления в печени
Д. Снижения активности гормон-чувствительной ТАГ-липазы в адипоцитах
4. Выберите правильные ответы.
При сахарном диабете в печени происходит:
A. Ускорение синтеза гликогена
Б. Увеличение скорости глюконеогенеза
B. Снижение скорости синтеза жиров
Г. Увеличение скорости синтеза ацетоацетата
Д. Повышение активности ацетил-КоА-карбоксилазы
5. Установите соответствие:
A. Высокий уровень инсулина Б. Алкалоз
B. Гипоглюкоземия
Г. Высокий уровень кортизола
Д. Аутоиммунное повреждение β-клеток
1. Только при сахарном диабете
2. Только при голодании
3. Только при стероидном диабете
6. Выберите правильные ответы.
При ИЗСД у больных наиболее часто обнаруживается:
A. Гиперглюкоземия
Б. Высокая скорость катаболизма инсулина
B. Концентрация инсулина в крови в норме или выше нормы Г. Антитела к β-клеткам поджелудочной железы
Д. Микроангиопатии
7. Установите соответствие:
A. Макроангиопатии Б. Катаракта
B. Микроангиопатии Г. Нефропатия
Д. Нейропатии
1. Активация сорбитольного пути в шванновских клетках
2. Глюкозилирование кристаллинов
3. Утолщение базальных мембран клубочков почек
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
2. А, Б, В, Д
4. Б, В, Г
5. 1-Д, 2-В, 3-Г
6. А, Г, Д
7. 1-Д, 2-Б, 3-Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Голодание
2. Фазы голодания
3. Сахарный диабет
6. Гиперглюкоземия - глюкозурия
7. Кетонемия - кетонурия
8. Азотемия - азотурия
9. Поздние осложнения сахарного диабета
10. Диабетическая кома
11. Кетоацидотическая кома
12. Гиперосмолярная кома
13. Лактоацидотическая кома
14. Микроангиопатии
15. Макроангиопатии
16. Нейропатии
17. Нефропатия
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Туристы не рассчитали запасы продовольствия и пока не добрались до первого населенного пункта вынуждены были голодать в течение 2 суток. Какие изменения в обмене веществ произойдут у этих туристов? Для объяснения:
а) укажите, как изменится концентрация глюкозы в крови у туристов к концу 2-го дня голодания;
б) напишите схемы процессов, за счет активации которых поддерживается нормальная концентрация глюкозы в первые сутки голодания;
в) назовите гормоны, которые регулируют уровень глюкозы в этот период;
г) представьте в виде схемы механизм действия этих гормонов;
д) укажите регуляторные реакции этих путей и способы их активации.
2. Биохимические исследования крови и мочи больного сахарным диабетом I типа показали:
Как изменятся эти показатели при однократном введении больному средней суточной дозы инсулина? В результате активации каких процессов произойдут эти изменения?
3. На прием к терапевту пришел пациент с жалобами на прогрессирующую слабость, сонливость, головокружение. Симптомы усиливались при голодании, что позволило врачу предположить наличие у больного гипоглюкоземии. Анализ крови подтвердил предположение (уровень глюкозы менее 2,5 ммоль/л) и показал к тому же сильно повышенный уровень С-пептида (более 800 пмоль/л). Пациент не страдает СД и не принимает сахаропонижающих препаратов. Наличие какого заболевания можно предположить? При ответе на вопрос:
а) назовите стимулы, влияющие на секрецию инсулина;
б) опишите влияние инсулина на углеводный и жировой обмен в печени, жировой ткани и мышцах;
в) объясните, чем опасна гипоглюкоземия и какие процессы в организме в норме предотвращают развитие гипоглюкоземии даже при голодании;
г) назовите заболевание и предположите метод лечения.
4. Пациент N обратился с жалобами на постоянное чувство голода, жажду, быструю утомляемость и усталость. Определение концентрации глюкозы натощак показало 130 мг/дл. Какие дополнительные исследования для установления диагноза необходимо провести в этом случае? Какие результаты можно прогнозировать в случае обнаружения у обследуемого диабета II типа?
5. Пациент с диагнозом ИЗСД длительное время не получал инъекций инсулина. После обращения больного к врачу и тщательного обследования назначена инсулиновая терапия. Через 2 месяца определение концентрации глюкозы в крови натощак показало 85 мг/дл, уровень глюкозилированного гемоглобина составил 14% общего уровня гемоглобина (норма 5,8-7,2%).
Каковы возможные причины высокой концентрации глюкозилированного гемоглобина у данного больного, несмотря на проводимое лечение? Приведите примеры глюкозилирования других белков. Объясните, к каким осложнениям это может привести.
6. Пациент 39 лет поступил с жалобами на сильную жажду, быструю утомляемость. Потеря веса за последние 5 недель составила 4 кг, несмотря на хороший аппетит и нормальную физическую нагрузку. Анализ крови показал, что концентрация глюкозы спустя 2 часа после приема пищи равна 242 мг/дл. Какое заболевание можно предположить у данного пациента? Что является причиной жажды? Как объяснить быструю утомляемость пациента?
Модульная единица 3 РЕГУЛЯЦИЯ ВОДНО-СОЛЕВОГО ОБМЕНА. РОЛЬ ВАЗОПРЕССИНА, АЛЬДОСТЕРОНА И РЕНИН-АНГИОТЕНЗИНОВОЙ СИСТЕМЫ. РЕГУЛЯЦИЯ ОБМЕНА СА 2 + И ФОСФАТОВ
Цели изучения Уметь:
1. Анализировать изменения метаболизма, возникающие при некоторых нарушениях водно-солевого обмена (гиперальдостеронизм, почечная гипертония).
2. Интерпретировать молекулярные механизмы нарушений синтеза и секреции гормонов, обеспечивающих регуляцию обмена кальция.
Знать:
1. Характеристики основных гормонов ВСО и этапы его регуляции.
2. Основные функции кальция в организме.
3. Механизмы гормональной регуляции обмена ионов кальция и фосфатов.
4. Проявления некоторых нарушений синтеза и секреции гормонов, регулирующих обмен кальция и фосфатов (гипо- и гиперпаратиреоидизм, рахит).
ТЕМА 11.8. РЕГУЛЯЦИЯ ВОДНО-СОЛЕВОГО ОБМЕНА
1. Основными параметрами водно-солевого гомеостаза являются осмотическое давление, рН и объем внутриклеточной и внеклеточной жидкости. Изменение этих параметров может привести к изменению кровяного давления, ацидозу или алкалозу, дегидратации и отекам. Основными гормонами, участвующими в регуляции водно-солевого баланса, являются антидиуретический гормон (АДГ), альдостерон и предсердный натриуретический фактор (ПНФ).
2. Антидиуретический гормон (АДГ), или вазопрессин, - пептид, содержащий девять аминокислот, соединенных одним дисульфидным мостиком. Синтезируется в виде прогормона в гипоталамусе, затем переносится в нервные окончания задней доли гипофиза, из которых секретируется в кровоток при соответствующей стимуляции. Перемещение по аксону связано со специфическим белком-переносчиком (нейрофизином) (рис. 11.17).
Стимулом, вызывающим секрецию АДГ, служит повышение концентрации ионов натрия и увеличение осмотического давления внеклеточной жидкости.
Наиболее важные клетки-мишени для АДГ - клетки дистальных канальцев и собирательные трубочки почек. Клетки этих протоков относительно непроницаемы для воды, и в отсутствие АДГ моча не концентрируется и может выделяться в количествах, превышающих 20 л в сутки (норма 1-1,5 л в сутки).
 Рис. 11.17. Секреция и механизм действия антидиуретического гормона:
Рис. 11.17. Секреция и механизм действия антидиуретического гормона:
А: 1 - супраоптический нейрон; 2 - паравентрикулярный нейрон; 3 - передняя доля гипофиза; 4 - задняя доля гипофиза; 5 - АДГ-нейрофизин; Б: 1 - АДГ связывается с мембранным рецептором V 2 , вызывая активацию аденилатциклазы (АЦ) и, как следствие, образование цАМФ; 2 - цАМФ активирует протеинкиназу, фосфорилирующую белки; 3 - фосфорилированные белки индуцируют транскрипцию гена белка аквапорина; 4 - аквапорин встраивается в мембрану клетки почечного канальца
Для АДГ существует два типа рецепторов - V 1 и V 2 . Рецептор V 2 обнаружен только на поверхности эпителиальных клеток почек. Связывание АДГ с V 2 сопряжено с аденилатциклазной системой и стимулирует активацию протеинкиназы (ПКА), которая фосфорилирует белки, стимулирующие экспрессию гена мембранного белка - аквапорина-2. Аквапорин-2 перемещается к апикальной мембране, встраивается в нее и образует водные каналы, через которые молекулы воды свободно диффундируют в клетки
почечных канальцев, а затем поступают в интерстициальное пространство. В результате происходит реабсорбция воды из почечных канальцев (см. рис. 11.17). Рецепторы типа V локализованы в мембранах гладких мышц. Взаимодействие АДГ с рецептором V 1 приводит к активации фосфолипазы С, в результате чего происходит высвобождение Са 2 + из эндоплазматического ретикулума и сокращение гладкомышечного слоя сосудов.
3. Несахарный диабет. Дефицит АДГ, вызванный дисфункцией задней доли гипофиза, а также нарушением в системе передачи гормонального сигнала, может приводить к развитию несахарного диабета. Основным проявлением несахарного диабета является полиурия, т.е. выделение большого количества мочи низкой плотности.
4. Альдостерон - наиболее активный минералокортикостероид - синтезируется клетками клубочковой зоны коры надпочечников из холестерола. Синтез и секреция альдостерона стимулируется при низкой концентрации Na+, высокой концентрации К+ и ренин-ангиотензиновой системой. Гормон проникает внутрь клеток почечных канальцев, взаимодействует со специфическим рецептором, цитоплазматическим или ядерным (рис. 11.18), и индуцирует синтез белков, которые обеспечивают реабсорбцию ионов натрия и экскрецию ионов калия.
Кроме того, белки, синтез которых индуцируется альдостероном, увеличивают количество насосов Na+, K+ - АТФазы, а также служат ферментами ЦТК, генерирующего молекулы АТФ для активного транспорта ионов. Суммарным результатом действия альдостерона является задержка NaCl в организме.
5. Главную роль в регуляции водно-солевого баланса, а значит, регуляции объема крови и артериального давления служит система ренин-ангиотензинальдостерон (рис. 11.19).
Протеолитический фермент ренин синтезируется юкстагломерулярными клетками почечных афферентных артериол. Уменьшение кровяного давления в приносящих артериолах, потеря жидкости или крови, снижение концентрации NaCl стимулируют высвобождение ренина. Образующийся в печени белок ангиотензиноген гидролизуется ренином с образованием ангиотензина I, который в свою очередь служит субстратом для АПФ (ангиотензин-превращающего фермента карбоксидипентидилпептидазы). От ангиотензина I отщепляется дипептид с образованием ангиотензина II. Через инозитолфосфатную систему ангиотензин II стимулирует синтез и секрецию альдостерона. Являясь также мощным сосудосуживающим веществом, ангиотензин II вызывает сокращение гладкомышечных клеток кровеносных сосудов, соответственно повышение кровяного давления и, кроме этого, вызывает жажду.
6. Система ренин-ангиотензин-альдостерон обеспечивает восстановление объема крови, который может уменьшиться в результате кровотечения, обильной рвоты, диареи, потения - состояний, являющихся сигналом для
 Рис. 11.18. Механизм действия альдостерона.
Рис. 11.18. Механизм действия альдостерона.
Альдостерон, взаимодействуя с внутриклеточными рецепторами, стимулирует синтез белков. Эти белки могут быть:
1 - компонентами натриевых каналов и увеличивать реабсорбцию Na + из мочи;
2 - ферментами ЦТК, активность которых обеспечивает продукцию АТР; 3 - Na+, K+ - АТФазой, насосом, который поддерживает низкую внутриклеточную концентрацию ионов натрия и высокую концентрацию ионов калия
высвобождения ренина. Этому способствует также снижение импульсации от барорецепторов предсердий и артерий в результате уменьшения внутрисосудистого объема жидкости. В результате увеличивается образование ангиотензина II и соответственно повышается в крови концентрация альдостерона, вызывая задержку ионов натрия. Это служит сигналом для осморецепторов гипоталамуса и секреции из нервных окончаний передней доли гипофиза АДГ, который стимулирует реабсорбцию воды из собирательных трубочек. Ангиотензин II, оказывая сильное сосудосуживающее действие, повышает артериальное давление, а также усиливает жажду. Поступающая с питьем вода в большей мере, чем это происходит в норме, задерживается в организме.
 Рис. 11.19. Система ренин-ангиотензин-альдостерон.
Рис. 11.19. Система ренин-ангиотензин-альдостерон.
АПФ - ангиотензинпревращающий фермент (другое название карбоксипептидилдипептидаза)
Уменьшение объема жидкости и снижение артериального давления активируют систему ренин-ангиотензин-альдостерон;
Ангиотензин II вызывает кратковременное сужение сосудов и повышение кровяного давления;
Альдостерон стимулирует задержку натрия, вследствие чего происходит высвобождение вазопрессина и усиливается реабсорбция воды;
Ангиотензин II вызывает также чувство жажды, что способствует увеличению жидкости в организме
Увеличение объема жидкости и повышение кровяного давления приводит к устранению стимула, который вызвал активацию ренин-ангиотензиновой системы и секрецию альдостерона и, как результат, приводит к восстановлению объема крови.
7. Снижение перфузионного давления в почечных клубочках может наступить и вследствие сужения (стеноза) почечной артерии или нефросклероза. В этом случае также включается вся ренин-ангиотензиновая система. Но поскольку исходные объем и давление крови при этом нормальные, включение системы приводит к повышению кровяного давления сверх нормы и развитию так называемой почечной гипертонии.
8. Гиперальдостеронизм - это заболевание, вызванное гиперсекрецией альдостерона надпочечниками. Причиной первичного гиперальдостеронизма (синдром Кона) является аденома надпочечников или диффузная гипертрофия клеток клубочковой зоны, вырабатывающих альдостерон. При первичном гиперальдостеронизме избыток альдостерона усиливает реабсорбцию натрия в почечных канальцах. Повышение концентрации Na+ в плазме служит стимулом к секреции антидиуретического гормона и задержке воды почками. Кроме того, усиливается выведение ионов калия, магния и протонов. В результате развивается гипернатриемия, вызывающая, в частности, гипертонию, гиперволемию и отеки; гипокалиемия, ведущая к мышечной слабости, а также дефицит магния и метаболический алкалоз. Причиной вторичного гиперальдостеронизма является повышенный уровень ренина и анигиотензина II, это стимулирует кору надпочечников и приводит к избыточному синтезу альдостерона. Клинические симптомы менее выражены, чем при первичном альдостеронизме. Одновременное определение концентрации альдостерона и активности ренина в плазме позволяет окончательно дифференцировать первичный (активность ренина в плазме снижена) и вторичный (активность ренина в плазме повышена) гиперальдостеронизм.
9. Предсердный натриуретический фактор (ПНФ) - пептид, который синтезируется и хранится в виде прогормона в кардиоцитах. Основной фактор, регулирующий секрецию ПНФ, - увеличение артериального давления. Основные клетки-мишени ПНФ - почки, надпочечники, периферические артерии. Рецептор ПНФ плазматической мембраны является каталитическим рецептором, обладающим активностью гуанилатциклазы. В результате
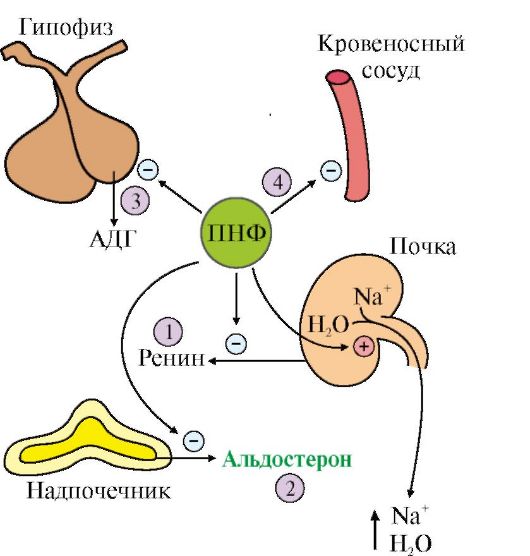 Рис. 11.20. Эффекты действия ПНФ:
Рис. 11.20. Эффекты действия ПНФ:
1 - ингибирует выделение ренина; 2 - ингибирует секрецию альдостерона; 3 - ингибирует секрецию АДГ; 4 - вызывает релаксацию сосудов
связывания ПНФ с рецептором гуанилатциклазная активность рецептора возрастает и происходит образование из ГТФ циклического ГМФ. В результате действия ПНФ ингибируется образование и секреция ренина и альдостерона. Суммарным эффектом действия ПНФ является увеличение экскреции Na+ и воды и понижение кровяного давления (рис. 11.20).
ПНФ обычно рассматривают как физиологический антагонист ангиотензина II, так как он вызывает расширение сосудов и потерю соли и воды.
ТЕМА 11.9. РЕГУЛЯЦИЯ ОБМЕНА КАЛЬЦИЯ И ФОСФАТОВ. СТРОЕНИЕ, СИНТЕЗ И МЕХАНИЗМ ДЕЙСТВИЯ ПАРАТГОРМОНА, КАЛЬЦИТРИОЛА И КАЛЬЦИТОНИНА
1. В организме взрослого человека содержится -1,2 кг кальция. Основной фонд кальция в организме - кальций костей (99% всего кальция в организме). Другой фонд - ионы кальция, растворенные в жидкостях или соединенные с белками жидкостей и тканей. Концентрация кальция внутри клеток зависит от его концентрации во внеклеточной жидкости. Концентрация Са 2 + в крови здоровых людей составляет 2,12-2,6 ммоль/л (9-11 мг/дл), во внутриклеточной жидкости - в тысячи раз меньше.
Кальций служит основным минеральным структурным компонентом костной ткани. Ионы кальция участвуют в мышечном сокращении, повышают проницаемость мембраны клеток для ионов калия, влияют на натриевую проводимость клеток, на работу ионных насосов, способствуют секреции гормонов, участвуют в каскадном механизме свертывания крови, служат важнейшими посредниками во внутриклеточной передаче сигналов.
Концентрация Са 2 + в плазме регулируется с высокой точностью: изменение ее всего на 1% приводит в действие гомеостатические механизмы, восстанавливающие равновесие. Основными регуляторами обмена Са 2+ в крови являются паратгормон, кальцитриол и кальцитонин.
2. Паратгормон синтезируется паращитовидными железами в виде препрогормона, который затем превращается в зрелый гормон путем частичного протеолиза. ПТГ секретируется в ответ на снижение концентрации кальция в крови. Основными органами-мишенями для гормона являются кости и почки (рис. 11.21).
Гормон инициирует каскад событий, связанный с аденилатциклазой остеобластов, которые стимулируют метаболическую активность остеокластов. Происходит мобилизация Са 2+ из кости и поступление фосфатов в кровь, а в дистальных канальцах почек стимулируется реабсорбция Са 2+ и уменьшается реабсорбция фосфатов, в результате чего восстанавливается нормальный уровень ионов кальция во внеклеточной жидкости.
3. Кальцитриол, как и другие стероидные гормоны, синтезируется из холестерола. Непосредственным предшественником кальциферола является холекальциферол (витамин D 3). Небольшое количество витамина D 3 содержится
 Рис. 11.21 Эффекты действия ПТГ:
Рис. 11.21 Эффекты действия ПТГ:
1 - ПТГ стимулирует мобилизацию кальция из кости; 2 - ПТГ стимулирует реабсорбцию ионов кальция в дистальных канальцах почек; 3 - ПТГ активирует образование 1,25(OH) 2 D 3 в почках, что приводит к стимуляции всасывания Са 2 + в кишечнике
в продуктах питания, но большая часть витамина, используемого в синтезе кальцитриола, образуется в коже из 7-дегидрохолестерола в ходе неферментативной реакции под действием ультрафиолетового света. Образование кальцитриола из витамина D 3 начинается в печени и заканчивается в почках (рис. 11.22).
В печени холекальциферол гидроксилируется по 25-му атому углерода с образованием 25-гидроксихолекальциферола. Гидроксилирование, протекающее в почках под действием фермента 1о-гидроксилазы, является скорость лимитирующей стадией и приводит к образованию кальцитриола 1,25(OH) 2 D 3 - активной формы витамина D 3 . Фермент этой реакции активируется низкой концентрацией в крови ионов Са 2 + и паратгормоном. Увеличение концентрации кальцитриола, напротив, тормозит синтез 1о-гидроксилазы почек, ингибируя образование гормона. Транспортируясь по крови в комплексе с белком-переносчиком, кальцитриол связывается с внутриклеточным рецептором, взаимодействует с хроматином и изменяет скорость трансляции. В результате в клетках-мишенях синтезируются белки, обеспечивающие всасывание кальция и фосфатов в энтероциты.
4. Кальцитонин - полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью. Гормон секретируется парафолликулярными
 Рис. 11.22 Схема синтеза кальцитриола:
Рис. 11.22 Схема синтеза кальцитриола:
1 - холестерол является предшественником кальцитриола; 2 - в коже 7-дегидрохолестерол неферментативно под действием УФ-облучения превращается в холекальциферол; 3 - в печени 25-гидроксилаза превращает холекальциферол в кальцидиол; 4 - в почках образование кальцитриола катализируется 1о-гидроксилазой
К-клетками щитовидной железы или С-клетками паращитовидной железы в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации Са 2 + и уменьшается при понижении концентрации Са 2 + в крови. Кальцитонин ингибирует высвобождение Са 2 + из кости и стимулирует его экскрецию почками с мочой.
5. Гипокальциемия и гиперкальциемия, когда концентрация кальция в плазме крови ниже или выше нормы, свидетельствует о патологии. Изменение уровня кальция в крови влияет на концентрацию кальция внутри клеток, что приводит к изменению порога возбудимости нервных и мышечных клеток, нарушению функционирования кальциевого насоса, снижению активности ферментов и нарушению гормональной регуляции метаболизма. При гипокальциемии наблюдаются гиперрефлексы, судороги, спазмы гортани. При гиперкальциемии наблюдается снижение нервно-мышечной возбудимости, может наступить глубокое расстройство нервных функций, психозы, ступор, кома.
6. Гиперпаратиреоз. Избыточная секреция паратгормона, возникающая в результате опухоли околощитовидной железы, диффузной гиперплазии желез, карциномы паращитовидной железы (первичный гиперпаратиреоз), приводит к повышению мобилизации кальция и фосфатов из кости, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия, которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляется общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья. Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии.
7. Гипопаратиреоз. Основным симптомом гипопаратироза, обусловленного недостаточностью паращитовидных желез, является гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические и сердечно-сосудистые нарушения, а также поражения соединительной ткани. У больного гипопаратиреозом отмечается повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
8. Рахит - заболевание детского возраста, связанное с недостаточной минерализацией костной ткани. Нарушение минерализации кости является следствием дефицита кальция и может быть обусловлено следующими причинами: недостатком витамина D 3 в пищевом рационе, нарушением всасывания витамина D 3 в тонком кишечнике, снижением синтеза предшественников кальцитриола из-за недостаточного времени пребывания на солнце, дефектом Ια-гидроксилазы, дефектом рецепторов кальцитриола в клетках-мишенях. Все это вызывает снижение всасывания кальция в кишечнике и снижение его концентрации в крови, стимуляцию секреции паратгормона и вследствие
этого - мобилизацию ионов кальция из кости. При рахите поражаются кости черепа, грудная клетка вместе с грудиной выступает вперед, деформируются трубчатые кости и суставы рук и ног, увеличивается и выпячивается живот. Основным способом предупреждения рахита является правильное питание и достаточная инсоляция.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Изучите механизмы регуляция поддержания водного баланса, запомните стимулы, вызывающие секрецию гормонов и особенности механизма их действия (рис. 11.19). Изобразите в виде схемы последовательность событий при восстановлении водно-солевого равновесия после приема соленой пищи.
2. У мужчины 23 лет при проведении хирургической операции по удалению опухоли из верхнего отдела передней доли гипофиза был затронут перешеек задней доли гипофиза. В послеоперационный период у пациента развилась полиурия. Как можно объяснить появление этого симптома у данного пациента? Для обоснования ответа:
а) назовите гормоны, синтезируемые в гипоталамусе и секретируемые из задней доли гипофиза;
б) нарисуйте схему передачи сигнала этого гормона на клетки-мишени;
в) назовите эффекты этого гормона.
3. Вспомните схему синтеза стероидных гормонов (рис. 11.8) и выпишите в тетрадь последовательность этапов синтеза альдостерона.
4. Составьте свою схему, иллюстрирующую эффекты альдостерона и механизм его действия.
5. Изучите схему регуляции синтеза и секреции альдостерона с участием системы ренин-ангиотензин (рис. 11.19) и подберите недостающие компоненты, обозначенные на схеме (рис. 11.23) цифрами.
6. Составьте свою схему, объясняющую основные результаты действия ПНФ (рис. 11.20) и ответьте на вопрос, на чем основан гипотензивный эффект
7. Заполните табл. 11.3.
Таблица 11.3. Характеристика гормонов, регулирующих водно-солевой обмен
 Рис. 11.23. Схема регуляции водно-солевого гомеостаза
Рис. 11.23. Схема регуляции водно-солевого гомеостаза
8. Заполните табл. 11.4.
Таблица 11.4. Характеристика гормонов, регулирующих обмен кальция и фосфатов
9. Используя схему рис. 11.22, укажите все возможные причины рахита и представьте схему механизма передачи сигнала кальцитриола на клеткимишени.
10. При гиповитаминозе D 3 нарушается процесс минерализации костей, уменьшается содержание в них кальция и фосфатов; концентрация Са 2 + в крови сохраняется в пределах нормы или несколько снижается. Составьте схему поддержания гомеостаза Са 2 + при гиповитаминозе D 3 и определите:
а) за счет каких источников поддерживается нормальная концентрация Са 2 + в крови в этом случае;
б) как изменится концентрация в крови кальцитонина и паратгормона.
11. Увеличение выведения кальция с мочой может быть причиной образования почечных камней, состоящих преимущественно из оксалата кальция. Назовите причины, по которым может увеличиваться выведение Са 2 .
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ.
В ответ на повышение осмотического давления возрастает синтез и секреция гормона:
A. Альдостерона Б. Кортизола
B. Вазопрессина Г. Адреналина Д. Глюкагона
2. Установите соответствие.
Место синтеза:
A. Печень Б. Почки
B. Гипоталамус Г. Надпочечники
Д. Поджелудочная железа
Метаболиты:
1. Вазопрессин
2. Альдостерон
3. Установите соответствие:
A. Стимул для синтеза и секреции - образование ангиотензина II Б. Стимул для секреции - повышение концентрации ионов натрия
B. Органы-мишени - периферические артерии
Г. Гиперпродукция гормона приводит к полиурии Д. Место синтеза - печень
1. Вазопрессин
2. Альдостерон
3. Ангиотензиноген
4. Выберите правильные ответы. Ангиотензин II:
A. Образуется в печени
Б. Является протеолитическим ферментом
B. Является субстратом ренина
Г. Стимулирует синтез альдостерона Д. Стимулирует сужение сосудов
5. Выберите правильные ответы.
Кальцитриол:
A. Стимулирует реабсорбцию кальция в почках
Б. Является предшественником 7-дегидрохолестерола
B. Стимулирует реабсорбцию натрия в почках
Г. Увеличивает скорость всасывания кальция в кишечнике Д. Стимулирует мобилизацию кальция из костей
6. Выберите правильные ответы.
Снижение концентрации Са 2 + в плазме крови вызывает:
A. Увеличение секреции паратгормона
Б. Ингибирование активности парафолликулярных клеток щитовидной железы
B. Гидроксилирование метаболитов витамина D 3 Г. Уменьшение экскреции кальция почками
Д. Повышение скорости резорбции кости
7. Выполните «цепное» задание:
а) в гипоталамусе синтезируется гормон:
A. Вазопрессин Б. Адреналин
B. Альдостерон Г. Кальцитриол
б) клетками-мишенями для данного гормона являются:
A. Клетки ЮГА
Б. Периферические артерии
B. Клетки собирательных трубочек и дистальных канальцев Г. Клетки клубочка нефрона
в) связываясь с рецепторами этих клеток, он стимулирует:
A. Аденилатциклазную систему Б. Фосфопротеинфосфатазу
B. Инозитолтрифосфатную систему Г. Ренин-ангиотензиновую систему.
г) в результате активации этой системы увеличивается количество белка:
A. Альбумина
Б. Транспортеров натрия
B. Аквапорина-2
Г. Транспортера калия
д) этот белок обеспечивает увеличение реабсорбции:
A. Ионов калия Б. Ионов кальция
B. Ионов натрия Г. Воды
8. Выберите правильные ответы. Паратгормон:
A. Транспортируется по крови в комплексе с белком-переносчиком Б. Секреция регулируется концентрацией кальция в крови
B. Недостаточность гормона приводит к снижению концентрации
Г. Для проявления биологической активности необходима вся молекула гормона целиком Д. Увеличивает эффективность всасывания воды в кишечнике
9. Выберите правильные ответы.
Вазопрессин:
A. Стимулирует повышение осмотического давления плазмы крови Б. Активирует протеинкиназу С в почках
B. Стимулирует реабсорбцию воды в почках
Г. Снижает осмотическое давление плазмы крови Д. Стимулирует экспрессию гена аквапорина-2
10. Установите соответствие:
A. Проявляет сосудосуживающий эффект Б. Стимулирует реабсорбцию Na+
B. Взаимодействует с мембранными рецепторами клеток-мишеней Г. Усиливает секрецию ренина
Д. Является протеолитическим ферментом
1. Альдостерон
2. Ангиотензин II
11. Выберите все правильные ответы. ПНФ:
A. Взаимодействует с мембранными рецепторами клеток-мишеней Б. Активирует фосфолипазу С
B. Активирует гуанилатциклазу
Г. Подавляет секрецию альдостерона Д. Увеличивает выведение воды и Na+
12. Установите соответствие:
A. В почках Б. В коже
B. В печени Г. В мозге
Д. В кишечнике
1. Превращение 7-дегидрохолестерина в витамин D 3 путем неферментативного фотолиза
2. Образование 1,25 (ОН)2D 3 в монооксигеназной реакции с участием NADPH
3. Индукция синтеза кальций-связывающего белка ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. В 7. а) А, б) В, в) А, г) В, д) Г
2. 1-В; 2-Г; 3-Б 8. Б, В
3. 1-Б; 2-А; 3-Д 9. В, Г, Д
4. Г, Д 10. 1-Б; 2-А; 3-Д
5. А, Г, Д 11. А, В, Г, Д
6. А, В, Г, Д 12 .1 - Б; 2 - В; 3 - Д
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Водно-солевой гомеостаз
2. Несахарный диабет
3. Система ренин-ангиотензин-альдостерон
4. Гиперальдостеронизм
5. Гиперкальциемия
6. Гипокальциемия
7. Гипопаратиреоз
8. Гиперпаратиреоз
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Некоторые формы гипертонии возникают вследствие различных почечных нарушений, например при сдавлении опухолью почечной артерии. Основным методом лечения в подобных случаях является удаление пораженного органа (почки). Однако улучшение состояния больных отмечается при назначении больным препаратов, являющихся ингибиторами АПФ. Нарисуйте схему, отражающую изменение водно-солевого обмена при сдавлении почечной артерии. В результате каких изменений наступает улучшение состояния больных?
2. К врачу обратился пациент с жалобами на частое мочеиспускание и постоянное чувство жажды. При обследовании отмечено увеличение суточного объема мочи при резком снижении ее плотности. Проведенный анализ показал, что уровень инсулина в пределах нормы, но выявлено повышение содержание гормона, ответственного за реабсорбцию воды. Предположите причину полиурии у данного больного? Для ответа на вопрос:
а) назовите этот гормон;
б) перечислите стимулы, вызывающие его секрецию;
в) назовите типы рецепторов для этого гормона и места их локализации;
г) приведите схему передачи сигнала данного гормона в почках;
д) опишите эффекты гормона в тканях-мишенях;
е) приведите схему регуляции секреции этого гормона.
3. Мужчина 48 лет обратился к врачу с жалобами на слабость, мышечные боли, запоры и недавно появившиеся приступы болей в спине и при мочеиспускании. При обследовании больному поставлен диагноз: первичный гиперпаратиреоидизм как следствие развития гиперсекреторной доброкачественной опухоли левой доли паращитовидной железы.
Объясните, почему при гиперпаратироидизме может развиться почечнокаменная болезнь? При решении задачи используйте схемы к заданию 5.
4. К педиатру обратилась женщина с жалобами на то, что ее двухлетний сын стал капризным, раздражительным, плохо ест. Появилась потливость, стул неустойчивый. При осмотре установлена податливость костей черепа, деформация грудной клетки. В биохимическом анализе крови уровень общего кальция - 1,57 ммоль/л (норма 2,3-2,8 ммоль/л). Предположите, каким заболеванием страдает этот ребенок. Для этого:
а) сравните количество общего кальция в крови у ребенка с нормой, дайте название этому состоянию;
б) укажите возможные причины, которые могут привести к развитию данного заболевания;
в) приведите схему синтеза гормональной регуляции обмена кальция;
г) укажите механизм действия гормонов, причины и последствия их недостаточности в организме;
5. Изучите схему:
Причины и последствия гипопаратиреоидизма (рис. 11.24). Составьте аналогичные схемы для:
а) гиперпаратиреоидизма;
б) рахита
 Рис. 11.24. Причины и последствия гипопаратиреоидизма
Рис. 11.24. Причины и последствия гипопаратиреоидизма
Экология здоровья: Гормональная система человека подвержена суточным ритмам. И от того, как отлажено эти ритмы сменяют друг друга, и будут зависеть успехи результативных бодибилдинг-тренировок. Здесь мы подробно остановимся на вопросах суточного колебания уровня наиболее важных анаболических и стрессовых гормонов, в конечном итоге предопределяющих достижения в наборе мышечной массе.
Суточные ритмы гормона роста, тестостерона и кортизола
Гормональная система человека подвержена суточным ритмам . И от того, как отлажено эти ритмы сменяют друг друга, и будут зависеть успехи результативных бодибилдинг-тренировок. Здесь мы подробно остановимся на вопросах суточного колебания уровня наиболее важных анаболических и стрессовых гормонов, в конечном итоге предопределяющих достижения в наборе мышечной массе.
Суточные ритмы гормона роста
Гормон роста или самотропин известен своими анаболическими и жиромобилизующими свойствами . Попутно ГР оказывает антикатаболическое и гипергликемическое действие, укрепляет иммунные функции, в детском и молодом возрасте способствует линейному росту. Гормон роста влечет укрепление соединительной ткани, стимулирует размножение клеток и накопление гликогена в печени и мышцах .
Эндогенная секреция гормона роста носит волнообразный характер . Максимум очередного пика ГР наблюдается каждые три-пять часов. В результате за полные сутки в среднем происходит 6-10 подъемов и спадов концентрации ГР. Самый амплитудный пик секреции ГР фиксируется ночью, через час-два после отхода ко сну и продолжается около двух часов к ряду.
Пробуждение в этот отрезок времени грозит потерей восстановительных реакций, необходимо провоцируемых высоким уровнем гормона роста. По этой причине крайне важно следовать нормальному режиму ночного сна , иначе физиологическое циклирование секреции ГР роста даст сбой, а за ним пострадает и весь обмен веществ. Причем спать нужно именно в темное время суток – такова природа нашего организма (эпифизарный гормон мелатонин, синтезирующийся в темное время суток, служит тем самым регулятором перехода от бодрствования ко сну).
Так, люди, занятые ночным трудом, даже при условии, что они отводят должное время на сон, имеют проблемы с секрецией ГР, а потому чаще страдают излишней полнотой и проблемами с сердечно-сосудистой системой . Все это верные признаки недостатка в организме гормона роста. Так что, если вы по-настоящему заинтересованы в высоком уровне продукции ГР, ни о каком ночном образе жизни и речи быть не может. Одно из двух…
С возрастом частота и объемы секреции ГР планомерно уменьшаются . Максимальный базовый уровень (т.е. средний за сутки) гормона роста характерен для детей раннего возраста и подростков в период полового созревания, знаменующийся заметным увеличением росто-весовых показателей.
Доступными способами увеличить продукцию собственного гормона роста являются:
качественный и глубокий ночной сон,
регулярные силовые тренировки,
высокобелковый рацион,
естественная гипогликемия.
Установлено, что при низких концентрациях глюкозы в крови происходит резкий выброс ГР, в последствие приводящий к росту утилизации жировых запасов, т.е. липолизу. Но при высокой концентрации жирных кислот в крови продуцирование ГР, напротив, замедляется. Непосредственно после приема пищи, богатой углеводами, уровень ГР также снижается. В свою очередь под воздействием силовой физической тренировки происходит увеличение выработки ГР, особенно эта реакция проявляется на фоне тяжелоатлетического малоповторного тренинга, увы, отрицательно сказывающегося на продукции тестостерона.
Известно, что анаболическое действие ГР проявляется лишь в присутствии гормона инсулина . Причем если роли ГР и инсулина противоположны в отношении углеводного обмена, то в плане синтеза протеина они – исключительно однонаправлены. Для проявления анаболического и жиросжигающего свойства ГР необходимо также нормальное воспроизводство гормонов щитовидной и половых желез.
Суточные ритмы тестостерона
Тестостерон – пожалуй, самый известный андрогенный гормон, проявляющий анаболические свойства по отношению к мышечной ткани.
Наибольшая концентрация гормона тестостерона у мужчин наблюдается рано поутру , во время и непосредственно после пробуждения, в 6-7 утра. К 9-11 часам базовый уровень тестостерона стабилизируется, продолжая совершать небольшие вторичные колебания. В среднем колебания вторичного фона (накладываемого на базовый) происходят с частотой 5-9 раз за час.
К 18 часам вечера наблюдается еще одно пиковое увеличение продукции тестостерона, к девяти-десяти часам вечера сменяющееся своим каскадным спадом. В это время мужской организм испытывает минимальный суточный уровень основного своего андрогена. Причем при регулярной половой жизни в вечернее время, данный спад может приходиться на более поздние часы – час или три ночи.
После интенсивной анаэробной нагрузки концентрация уровня тестостерона в крови минимальна . Но это не означает, что организм в этом момент испытывает тестостероновый голод тотально. Просто весь тестостерон из плазмы устремляется во внутриклеточное пространство, включаясь в процесс регуляции синтеза клеточного белка. Снижение уровня тестостерона наблюдается и после употребления в пищу простых углеводов, в особенности, глюкозы. Низкая физическая активность ведет к планомерному снижению базового уровня тестостерона в любом возрасте .
Для поддержания природных пиков тестостерона и времени их проявления необходимо придерживаться тех же несложных правил, что и в случае с ГР:
соблюдать режим сна и бодрствования,
питаться достаточным количеством белка,
избегать стрессов, и перетренированности в том числе,
регулярно тренироваться с полноценным восстановлением.
Суточные ритмы кортизола
Кортизол – глюкокортикоидный гормон, продуцируемый корой надпочечников и возбуждающий нервную систему.
Минимальный уровень кортизола диагностируется от полуночи до середины ночного периода сна , а ближе к утру наблюдается его планомерный подъем. Утром уровень кортизола достигает своего локального пика. Что закономерно приводит к увеличению артериального давления, частоты сердечных сокращений, тонуса сосудов и к снижению показателей свертываемости крови. Все это необходимо человеку для перехода в состояние бодрствования.
Утренний подъем уровня кортизола наблюдается у разных людей в несколько разное время. У одних – в 4-5 часов (у жаворонков), у других – в 7-8 (у сов). Считается, что именно из-за утреннего подъема уровня кортизола в это время суток наблюдается наибольшее число сердечных приступов и инсультов. После пробуждения в течение порядка 12 часов базовый уровень кортизола сохраняет свои средние значения, но теряя позиции к вечеру (к 17-18 часам), а к полуночи и вовсе. После цикл повторяется.
При снижении функции щитовидной железы наблюдается снижение катаболизма кортизола, что в свою очередь приводит к росту его концентрации. Курение, состояние алкогольного опьянения и печеночная недостаточность также влекут увеличение уровня стрессового гормона кортизола. Повышенный уровень кортизола наблюдается при стрессовых ситуациях, диабете и сильной степени ожирения.
Стоит обратить внимание и на тот факт, что даже у в принципе здоровых людей в состоянии стресса кортизол продолжает индуцироваться пропорционально времени патологического воздействия стрессового агента.
Отсюда и известное правило: избегайте всевозможных стрессов, а те, что невозможно устранить, минимизируйте .
Последнее замечание в полной мере может быть отнесено и к тренировкам с отягощениями.
Известно, что выброшенный в кровь кортизол метаболизируется в печени и выводится с мочой. Период его полураспада составляет порядка полутора-двух часов, что служит определенного рода ориентиром в плане тренировочного стресса, получаемого в тренажерном зале.
При нарушениях суточных биоритмов вечернего снижения уровня кортизола не наблюдается, что в свою очередь приводит к чрезмерному воздействию на организм этого регулирующего гормона. Очевидно, что и в случае с кортизолом без пунктуальной приверженности спортивному режиму никак не обойтись. опубликовано . Если у вас возникли вопросы по этой теме, задайте их специалистам и читателям нашего проекта .
Противоестественно, когда пища вместо того, чтобы служить источником жизни и здоровья, приносит вред. К сожалению, подобное случается и весьма нередко. Причины вредного влияния пищи на организм различны.
Неблагоприятно для организма недоедание, которое возникает не только из-за отсутствия пищи, но и под влиянием пропаганды «голодных» диет. У многих людей даже развивается болезненный страх «стать толстым». В этих случаях избегают калорийной пищи, искусственно вызывают рвоту, применяют сразу после еды слабительные и мочегонные средства. Подобные мероприятия не только снижают массу тела, но и могут привести к авитаминозам и иным нарушениям в организме, в частности в половой сфере. Дело в том, что отложение жировой ткани у женщины имеет определенный биологический смысл, ибо жир активизирует половые гормоны. Специальными исследованиями установлено, что у женщин с массой тела ниже 43 кг угнетена функция половых гормонов и, соответственно, снижено либидо. Таким образом, масса тела и жировые отложения (до определенного уровня) обусловливают гормональный статус женского организма. Слепо следовать моде и стремиться к «идеальной» фигуре женщинам в детородном периоде вряд ли целесообразно. Резкое снижение потребления углеводов также влечет за собой изменения гормонального фона, в частности нарушения менструального цикла.
Злоупотребление слабительными и диуретическими (мочегонными) препаратами вызывает изменения в водно-солевом (электролитном) обмене. К признакам этих нарушений относятся бледность, потливость, тремор (дрожание) пальцев рук, напряженность мышц. В особенно тяжелых случаях наблюдают судорожные припадки, напоминающие эпилептические.
У многих людей повышен интерес к пище, что, как правило, приводит к перееданию и ожирению. Самое правильное - соблюдать во всем меру: не голодать и не переедать, ориентируясь на самочувствие и показатели массы тела.
- Пищевая аллергия
- Мигрень и питание
- Пища и инфекционные болезни
- Жиры, стресс и питание
- Сладкая еда – горькая расплата
Смотрите также
Разнообразие возбудителей и вызываемых ими заболеваний
Ни одна из попыток построить простую систему
классификации патогенных вирусов пока не увенчалась успехом. Нет такого
клинического синдрома, который мог бы быть вызван вирусом только одного типа, и...
Значение здорового питания
К
счастью, осознание необходимости следить за своим питанием и в нашей стране в
последние годы приобретает все большую популярность. Поэтому некоторые
требования таких врачей, как д-р Гей и ему под...
Сборка вириона
На первой стадии формирования вириона происходит
синтез его индивидуальных белков. Белки каждого из трех классов синтезируются,
по-видимому, независимо друг от друга и часто на отдельных м РНК.
...
Консультации проводит доктор
Андрей Юрьевич Лобузнов
Гормоны - это биологически активные вещества, вырабатываемые в организме определенными клетками или железами внутренней секреции. В сложном взаимодействии друг с другом, гормоны регулируют все жизненно важные процессы человеческого организма. Гормональная система совместно с нервной, обеспечивает деятельность нашего организма как единого целого.
Все биологические процессы регулируются определенными механизмами, которые обеспечивают безопасную и здоровую работу организма. Гормоны, ответственные за гомеостаз (устойчивое равновесие), реагируют на внешние факторы, способные его нарушить. Когда мы едим и перевариваем пищу, ее биохимические компоненты вызывают соответствующие гормональные реакции. Процесс пищеварения и коррекцию нарушения баланса, возникающую вследствие притока переваренной пищи, контролирует «большая команда» гормонов. Подробнее о четырех из «большой команды».
Инсулин, лептин, глюкагон и кортизол
Четыре этих гормона (взаимодействуя с другими) формируют сложнейшую цепочку обратных связей, воздействующих на все системы организма как единая «команда участников».
Если нарушен гормональный баланс – ваше здоровье в опасности!
Начнем с инсулина и лептина, так как эти гормоны сложно разделить.
Инсулин
Инсулин – это белковый («строительный, хранящий») гормон, выделяемый бета-клетками поджелудочной железы. Он воздействует практически на все клетки организма и непосредственно контролирует запасы энергии, рост и восстановление клеток, репродуктивную функцию и, что особенно важно, – уровень сахара в крови.
Инсулин «открывает» доступ к клеткам, давая тем самым возможность клеткам использовать и запасать нутриенты. Выделение инсулина непосредственно связано с потреблением углеводов: расщепляясь, они абсорбируются в кровоток, что приводит к повышению в крови уровня сахара (глюкозы).
Для оптимального здоровья этот уровень должен поддерживаться в норме - не слишком низко, но и не слишком высоко, а инсулин – регулятор, который препятствует чрезмерному повышению уровня сахара в крови.
Если у вас здоровый обмен веществ, то при правильном питании уровень сахара в крови повышается умеренно. Поджелудочная железа выделяет оптимальное количество инсулина, подавая таким образом «сигнал» клеткам о том, сколько сахара следует сохранить в крови. Сигнал обозначает: «храните эти нутриенты». Клетки, чувствительные к инсулину отреагируют должным образом, извлекут сахар из кровотока и сохранят его, тем самым регулируя уровень глюкозы в крови.
Регулирование уровня сахара в крови посредством инсулина жизненно важно для организма. Повышенный уровень глюкозы пагубно действует на многие системы организма, включая печень, почки, кровеносные сосуды, мозг и периферическую нервную систему.
Хронически высокий уровень сахара в крови (гипергликемия) опасен, поэтому контроль сахара очень важен для здоровья.
Как только клетки извлекли сахар из кровотока, глюкоза может либо сразу использоваться организмом для получения энергии, либо сохраняться впрок. Большая часть глюкозы находится в печени и мышцах в качестве сложного углевода, который называется гликоген. Из печени гликоген может легко конвертироваться обратно в глюкозу и направить ее в кровоток, если организм нуждается в энергии. Из мышечных клеток гликоген направить в кровь нельзя. Он остается в мышцах, обеспечивая их работоспособность.
«Резервуары» организма для хранения углеводов (печень и мышцы) условно можно сравнить с бензобаком автомобиля. Полный бензобак дальше нельзя наполнять – он не безразмерный. Там содержится определенное количество гликогена, что позволяет организму поддерживать активную работоспособность на протяжении примерно 90 минут. Но углеводы расходуются именно в процессе интенсивной деятельности. Если вы сидите за столом на работе, смотрите телевизор или лежите на диване вы не используете «запасы топлива»
Гормональные проблемы начинаются, в том числе, с избыточного потребления углеводов: хронического переедания стимулирующей еды. Когда организму потребуется «топливо», он будет расходовать то, чего в организме больше, то есть сахар. Если сахара слишком много, то именно он используется в качестве источника в обменных процессах энергии, а не жир. Он накапливается в организме.
Когда хранилища энергии в печени и мышцах переполнены, печень (и ваши жировые клетки) конвертирует избыточную глюкозу в пальмитиновую кислоту (тип насыщенного жира), которая в свою очередь участвует в создании триглицеридов (триглицериды вместе с холестерином – основные источники жира, циркулирующего у нас в крови, поэтому высокий уровень триглицеридов должен восприниматься как сигнал опасности).
Лептин
Лептин – гормон «энергетического равновесия», который выделяется преимущественно жировыми клетками пропорционально объему накапливаемого жира. Лептин участвует в регулировании энергетических затрат, поддерживая таким образом нужный уровень жира в организме. Чрезмерное потребление стимулирующих углеводов приводит к хронически повышенному уровню триглицеридов и сахара в крови. Чем это грозит? Появляется устойчивость к лептину и увеличивается количество накапливаемого жира. Основная задача лептина - регулировать уровень нашего голода и активности, поддерживая энергетический баланс, чтобы человек был не толстым, но и не худышкой!
Жир нужен организму – он помогает нам выживать, например, не есть по несколько дней при болезни. Но тело наше - пессимист, ждет, что запасы еды в организме на исходе, и в предчувствии «надвигающегося голода» аккумулирует энергию в виде жира. Но в организме всегда имеется излишек мгновенной энергии в виде глюкозы, доступной к использованию 24 часа в сутки, 7 дней в неделю, 365 дней в году
Жир – хранилище энергии, поэтому организму важно уметь «измерять», сколько энергии (жира) доступно в определенный промежуток времени. Жировые клетки выполняют эту функцию посредством секреции лептина, сообщая мозгу, что вес в норме.
Если метаболизм замедляется (в том числе из-за изменения уровня гормонов), вы начинаете набирать и вес и жир. Повышается уровень лептина, жировые клетки информируют мозг, что запасов энергии вполне достаточно. В ответ мозг «командует» повысить активность и снижает чувство голода, чтобы вы больше двигались и меньше ели. Такая система энергетического баланса создана для контроля нормального количества жира в организме. Проблемы начинаются тогда, когда продукты питания провоцируют неумеренное потребление углеводов.
Именно сахар сначала сжигается организмом для получения энергии, а жир откладывается про запас. Избыточное количество глюкозы и триглицеридов в кровотоке поступает в мозг и начинает нарушать способность вашего мозга «слышать» сигналы лептина. Это вызывает так называемую устойчивость к лептину.
Тощий жир
Запасов внутреннего жира (жира, который хранится внутри и вокруг ваших органов) достаточно, чтобы спровоцировать гормональный дисбаланс, включая и устойчивость к лептину).
Мы называем это тощим жиром - человек с виду худощавый, мышечной массы у него мало, зато много нездоровой жировой ткани. Создается серьезный гормональный дисбаланс. Мозг не реагирует на сигналы лептина, что жира уже достаточно. Он думает, что вы слишком худы.
Ночные набеги на холодильник
Сообщения лептина (или их отсутствие) сильнее вашей силы воли. Вы замечаете, что набрали вес, и пытаетесь умерить аппетит, но приказы мозга побеждают. Они сильнее. Отличительная черта устойчивости к лептину – неконтролируемое желание поесть после ужина. Вы не можете сопротивляться силе, с которой вас тянет к холодильнику. Это не отсутствие силы воли: это ваш мозг реагирует на сигналы лептина, преодолевая волевые решения ограничить себя в еде.
Устойчивость к лептину означает, что вы набираете вес и множите лептин. Мозг на это не реагирует, у него «сверхзадача» – сохранять энергию, поэтому он замедляет метаболизм, и провоцирует переедание. Круг замкнулся.
Возвращаемся к инсулину
Помните чувствительность к инсулину? Она наступает, когда сообщение инсулина о необходимости «хранить питательные вещества» получают клетки, извлекающие глюкозу из кровотока, и запасают ее, регулируя уровень глюкозы в крови.
В отличие от чувствительности к инсулину, существует также инсулиновая резистентность. Устойчивость к лептину влечет за собой инсулиновую резистентность. Это приводит к повышенному уровню инсулина в плазме крови по сравнению с необходимым для имеющегося уровня глюкозы.
Итак: вы хронически переедаете, потому, что в сверхнормально стимулирующей пище, не содержатся нужные питательные вещества. Как следствие, вырабатывается устойчивость к лептину, то есть мозг думает, что вы худы, хотя отражение в зеркале говорит обратное: в теле и печени накапливается жир, и избыток глюкозы и триглицеридов в кровотоке.
Избыточная глюкоза должна где-то храниться. Скопление большого количества энергии в клетках провоцирует клеточные нарушения. Чтобы защититься от «переполнения», клетки вырабатывают устойчивость к инсулину. Как только это происходит, они теряют способность слышать сообщение инсулина о том, что следует консервировать питательные вещества. Поджелудочная железа посылает сообщение (через инсулин) «консервировать», но клетки «не слышат», и уровень сахара в крови остается высоким.
Устойчивость к инсулину предполагает, что поджелудочная железа будет вырабатывать еще больше инсулина, чтобы принудить питательные вещества проникнуть в заполненные клетки. Но такое «принудительное питание» создает оксидативный стресс (процесс повреждения клетки в результате окисления) и опять повышает уровень жира в крови, что наносит клеткам еще больший вред. Поврежденные клетки продолжают предпринимать попытки защититься, еще сильнее повышая инсулиновую резистентность… и круг замыкается.
Системная воспалительная реакция
Переполненные и живущие в основном за счет сахара клетки, вырабатывают свободные радикалы (активные формы кислорода), вызывающие нарушения на клеточном уровне. Реакция на них представляет целую серию иммунных ответов. В том числе выделение химических веществ, вызывающих воспаление, и иммунных клеток, выступающих как «службы экстренного реагирования», для восстановления поврежденных тканей. Такая иммунная реакция называется системной воспалительной реакцией, еще больше повышающей инсулиновую резистентность.
На этом этапе в организме находится избыточное количество глюкозы, которая устойчива к инсулину. Это обусловливает гипергликемию - хронически повышенный уровень сахара в крови и наносит организму непоправимый вред, особенно бета-клеткам поджелудочной железы, вырабатывающим инсулин.
Хроническая гипергликемия
Хроническая гипергликемия заставляет поджелудочную железу вырабатывать больше инсулина, чтобы справляться с избыточным сахаром в крови. В итоге поврежденные постоянной гипергликемией бета-клетки разрушаются, точнее, просто отмирают из-за высокого уровня сахара в крови и последующего оксидативного стресса.
Организм уже не может производить достаточное количество инсулина, чтобы управлять уровнем сахара в крови, - именно так токсичный уровень сахара в крови и инсулиновая резистентность приводят к диабету 2-го типа.
Но еще задолго до диабета ваше здоровье начинает испытывать последствия такого образа жизни. Гипергликемия вредна, но и гиперинсулинемия (хронически высокий уровень инсулина) является фактором риска развития заболеваний, связанных с неправильным образом жизни: диабет, ожирение, сердечные приступы, инсульт и болезнь Альцгеймера.
Хронически высокий уровень инсулина очень вреден, и контроль за ним важен для долгосрочного здоровья. Если вы устойчивы к инсулину и к лептину и продолжаете в избытке потреблять углеводы, поджелудочная железа должна выделять постоянно увеличивающееся количество инсулина, чтобы извлечь глюкозу из кровотока. Механизм регулирования сахара в крови разладился и инсулин может направить большое количество сахара в другом направлении - то, что раньше было слишком высоким, сейчас стало слишком низким (это состояние называют «реактивной гипогликемией»). Слишком низкий уровень сахара влечет ряд побочных эффектов - человек становится капризным, уставшим, рассеянным и… постоянно голодным.
На самом деле организм не нуждается в калориях, но из-за «ложных» сообщений, которые посылает ваше тело: «вы слишком худой, уровень сахара в крови низкий», вы все больше едите то, что создало столько проблем.
 Если вы без промедления не измените свои привычки питания, устойчивость к инсулину очень скоро может перерасти в диабет 2-го типа. Он наступает при серьезности инсулиновой резистентности и отмирания бета-клеток тогда, когда организм больше не может производить инсулин в нужном для поддержания здорового уровня сахара в крови, количестве.
Если вы без промедления не измените свои привычки питания, устойчивость к инсулину очень скоро может перерасти в диабет 2-го типа. Он наступает при серьезности инсулиновой резистентности и отмирания бета-клеток тогда, когда организм больше не может производить инсулин в нужном для поддержания здорового уровня сахара в крови, количестве.
Диабет поражает весь организм и вызывает тяжелейшие последствия: ожирение, глаукому и катаракту, потерю слуха, нарушение периферического кровообращения, повреждение нервов, кожные инфекции, высокое давление, болезни сердца и депрессия. Ежегодно десятки тысяч людей умирают в результате осложнений, вызванных диабетом.
Глюкагон – это катаболический гормон доступа к энергии, который секретируется из альфа-клеток поджелудочной железы в ответ на потребность организма в энергии или после нескольких часов голодания. Он стимулирует расщепление в печени запасного углевода – гликогена и тем самым – уровень глюкозы в крови. Глюкагон открывает односторонний путь из клеток печени и жира и позволяет получать доступ к законсервированной организмом энергии. Хронический стресс, потребление белка и низкий уровень сахара в крови провоцируют выделение глюкагона. Функция глюкагона подавляется повышенным уровнем инсулина и свободными жирными кислотами в крови.
Три «г»
Глюкоза – одна из форм сахара, содержащаяся в пище, а также тип сахара в кровотоке.
Гликоген - законсервированная форма глюкозы, которая хранится в печени и мышцах.
Глюкагон - гормон доступа к энергии, который вызывает конверсию гликогена в печени обратно в глюкозу и выделяет ее в кровоток для использования в качестве источника энергии.
Как правило, в отдельно взятый момент в вашем кровотоке находится около пяти граммов (чайная ложка) сахара. По разным причинам, во время стресса или непродолжительного голодания, уровень сахара в крови может упасть слишком низко (гипогликемия).
Поставки глюкозы в мозг являются вопросом жизни или смерти в буквальном смысле этого слова: если уровень глюкозы в крови опустится слишком низко, человек впадает в кому. Поэтому организм располагает различными механизмами собственной безопасности, не допускающими сбоев в системе. Один из таких механизмов – гормон глюкагон, который синтезируется в альфа-клетках поджелудочной железы.
Если инсулин поддерживает безопасный уровень глюкозы в крови, то глюкагон предотвращает падение уровня сахара в крови и обеспечивает доступ к запасам энергии. Когда организм ощущает снижение нормального уровня сахара в крови, альфа-клетки поджелудочной железы выделяют глюкагон. Он диктует организму расщепить законсервированный жир и конвертировать содержащийся в печени гликоген (и при необходимости - белок из мышц) в глюкозу, выделяя ее в кровоток, чтобы поддерживать нормальный уровень сахара.
Но есть одно «но». Глюкагон дает команду клеткам выделить законсервированную энергию и использовать жир, если инсулин в норме. Если уровень инсулина повышен, нутриенты консервируются так же быстро, как и мобилизуются. Это значит, что при повышенном уровне инсулина энергии консервируется больше, чем ее можно извлечь в дальнейшем.
Когда у вас вырабатывается устойчивость к инсулину и вы употребляете продукты с высоким содержанием углеводов, уровень инсулина остается высоким и «отзывается эхом» по всему телу на протяжении нескольких часов. Между приемами пищи, когда вы должны использовать в качестве энергии законсервированный жир, вы не можете этого сделать - инсулин все еще «требует», а глюкагон ему «перечит».
Нужно бороться с привычками питания, которые хронически повышают уровень сахара в крови и провоцируют развитие устойчивости к лептину и инсулину. Вывод простой. Глюкагон не стабилизирует уровень сахара в крови и не обеспечит доступ к жиру для получения энергии, если уровень инсулина будет постоянно повышен.
«Гормон стресса», вырабатывается корой надпочечников. Участвует в регуляции углеводного, белкового и жирового обмена в организме. Стимулирует распад белков и синтез углеводов. Выделяется как реакция на низкий уровень сахара, физический или физиологический стресс, интенсивную или длительную физическую активность, недосыпание. Кортизол играет важнейшую роль в метаболизме соли, нормализации кровяного давления и иммунной функции, обладает противовоспалительными свойствами, регулирует уровень энергии.
Хронически повышенный уровень кортизола вызывает инсулиновую резистентность и повышает уровень лептина.
Нормальные ритмы кортизола очень важны для формирования памяти организма и будущего доступа к ней.
Секреция кортизола связана со многими факторами (сон, физические упражнения, психологический стресс), но привычки питания оказывают на нее особое влияние.
Одна из задач кортизола - помочь глюкагону поддерживать нормальный уровень сахара в крови. Когда организм чувствует, что этот уровень снижается (например, если вы давно не ели) или резко повышается (например, вследствие резкого выброса сахара в кровь, если вы устойчивы к инсулину), он реагирует на эту стрессовую ситуацию выделением кортизола. Кортизол побуждает глюкагон работать, расщепляя энергию гликогена в печени или в мышечной ткани, и отправляя ее в кровоток.
Проблемы со здоровьем начинаются, когда у вас вредные привычки питания. Надпочечники начинают непрерывно выделять кортизол. Когда он «выходит из-под контроля», то вызывает множество нарушений - некоторые прозвучат для вас до боли знакомо.
Если вы хронически недосыпаете, часто перенапрягаетесь или испытываете постоянный психологический стресс, длительно голодаете – уровень кортизола выходит из нормы. Чрезмерное ограничение калорий также повышает уровень кортизола.
- Хронически повышенный уровень кортизола на самом деле «съедает» мышечную массу, зато оставляет лишний жир.
- Хронически повышенный уровень кортизола нарушает процесс поглощения глюкозы из кровотока и усиливает расщепление гликогена в печени, таким образом повышается уровень глюкозы в крови.
- Хронически повышенный уровень кортизола повышает уровень сахара в крови, что в свою очередь может повысить устойчивость к инсулину.
- Повышенный уровень кортизола провоцирует увеличение веса, вызывая обусловленное стрессом переедание
- Кортизол стимулирует позыв есть богатую углеводами пищу, которая способна снизить стресс… но при этом увеличивается объем вашего тела.
Повышенный уровень кортизола направляет жировую массу тела в область живота (вместо, скажем, ягодиц или бедер). Чрезмерное количество жира в брюшной полости (абдоминальный тип ожирения) - часть метаболического синдрома, совокупность тесно связанных симптомов. К ним относятся ожирение, высокое кровяное давление, инсулиновая резистентность / гиперинсулинемия, гипергликемия, повышенный уровень триглицеридов, а также низкий уровень «хорошего» холестерина или липопротеинов высокой плотности. Абдоминальный тип ожирения (ожирение по типу «яблока») – прямой фактор риска для развития болезней сердца, инсульта, атеросклероза и заболевания почек.
Наконец, повышенный уровень кортизола оказывает плохое влияние на работу щитовидной железы, что приводит к нарушению обмена веществ. Поэтому если вы устойчивы к лептину, к инсулину, и у вас хронический стресс, вы не можете похудеть, соблюдая маложирную и некалорийную диету!
Поскольку сигнал лептина о насыщении не регистрируется в вашем мозге, вы постоянно переедаете - особенно это касается вредной еды Постоянная зависимость от сахара и переработанной, богатой углеводами пищи, на протяжении многих лет обеспечивают вам повышенный уровень сахара и инсулина в крови.
Диабет практически дышит вам в спину. Вы продолжаете медленно, но верно накапливать жир, а у глюкагона нет никаких шансов донести до ваших клеток сообщение о необходимости использовать жир в качестве топлива, и вы безнадежно зависите от сахара для получения энергии.
Отчасти ввиду нарушений, связанных с уровнем кортизола, ваше тело упрямо не отпускает жир вокруг талии даже тогда, когда вы всеми силами пытаетесь ограничить потребление калорий - это еще сильнее затрудняет процесс похудения.
Помните, что гормоны создают и закрепляют такие нарушения. И самый серьезный фактор, влияющий на баланс и функцию таких гормонов, - это еда.
Здоровье начинается с правильной еды
 Для многих людей эта информация нова, но мы надеемся, что она наведет вас на определенные мысли. Почему я так хочу сладкого поздней ночью? Почему я не могу похудеть, хотя меньше ем? Почему каждый день в 3 часа дня я ощущаю упадок сил? Почему каждую ночь я просыпаюсь в 2 или 3 часа? Почему я становлюсь капризным, если не ем каждые 2 часа? Откуда этот «пивной животик» - я же ем здоровую пищу!
Для многих людей эта информация нова, но мы надеемся, что она наведет вас на определенные мысли. Почему я так хочу сладкого поздней ночью? Почему я не могу похудеть, хотя меньше ем? Почему каждый день в 3 часа дня я ощущаю упадок сил? Почему каждую ночь я просыпаюсь в 2 или 3 часа? Почему я становлюсь капризным, если не ем каждые 2 часа? Откуда этот «пивной животик» - я же ем здоровую пищу!
Если все вышеперечисленное очень похоже на вашу жизненную ситуацию, есть два факта, которые вас успокоят.
Во-первых, вы теперь знаете причину ваших проблем. Во-вторых, в медицинском центре «Эвеналь» мы поможем вам решить эти проблемы.
Даже после десятилетий плохого питания и гормональных нарушений, через устойчивость к лептину и инсулину, зачастую даже через диагностику диабета 2-го типа состояние вашего здоровья обратимо.
Вы можете научиться есть в меру, вернуть себе чувствительность к лептину и инсулину, заново обучить ваше тело сжигать жир и восстановить нормальный уровень кортизола, если будете делать одну простую вещь.
Замените продукты, которые кладете на вашу тарелку
- Еда должна вызывать в организме здоровую гормональную реакцию. Хроническое чрезмерное потребление углеводов в виде еды «без тормозов» приводит к зависимости от сахара в качестве топлива, к накоплению жира в теле, к накоплению триглицеридов в печени, а также к избытку глюкозы и триглицеридов в кровотоке.
- Избыток глюкозы и триглицеридов провоцирует устойчивость к лептину в мозге.
- Устойчивость к лептину предполагает, что ваш мозг не слышит посыл лептина и продолжает наивно думать, что ваш вес - в пределах нормы. Это ведет к еще большему перееданию и замедлению метаболизма (частично это касается и метаболизма гормонов щитовидной железы).
- Устойчивость к лептину провоцирует развитие устойчивости к инсулину, при которой клетки теряют чувствительность к сообщению инсулина о том, что пришло время консервировать питательные вещества. Принудительное обеспечение клеток нутриентами наносит вред, приводит к воспалению и хроническому повышению уровня сахара и инсулина в крови.
- Хронически повышенный уровень сахара и инсулина провоцирует появление факторов для развития диабета 2-го типа и других заболеваний и состояний, связанных с неправильным образом жизни.
- Глюкагон поможет вам стабилизировать уровень сахара и использовать жир в качестве топлива только при условии, что уровень сахара в крови при этом не будет повышен.
- Кортизол - «гормон стресса». Периоды голодания или чрезмерного ограничения калорий наряду с отсутствием нормального сна или стрессом могут привести к хронически повышенному уровню кортизола.
- Хронически повышенный уровень кортизола приводит к повышению уровня сахара, что в свою очередь вызывает устойчивость к инсулину и провоцирует увеличение веса в области живота - а это уже признак метаболического синдрома.






