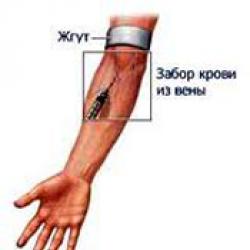
Denaturasi protein: inti proses, perubahan sifat protein, jenis denaturasi. Pada suhu berapa terjadi denaturasi protein Urutan proses denaturasi protein
Denaturasi protein adalah proses yang berhubungan dengan pelanggaran struktur molekul sekunder, tersier, kuaterner di bawah pengaruh berbagai faktor.
Fitur proses
Hal ini disertai dengan terungkapnya ikatan polipeptida, yang awalnya disajikan dalam larutan sebagai kumparan acak.
Proses denaturasi protein disertai dengan hilangnya cangkang hidrasi, pengendapan protein, dan hilangnya sifat aslinya.
Di antara faktor utama yang memicu proses denaturasi, kami menyoroti parameter fisik: tekanan, suhu, aksi mekanis, pengion, dan radiasi ultrasonik.
Denaturasi protein terjadi di bawah pengaruh pelarut organik, asam mineral, basa, garam logam berat, alkaloid.

Jenis
Dalam biologi, ada dua varian denaturasi:
- Denaturasi protein reversibel (renaturasi) melibatkan proses di mana protein yang terdenaturasi, setelah penghilangan semua zat yang mengalami denaturasi, dikembalikan ke struktur aslinya. Dalam hal ini, aktivitas biologis kembali sepenuhnya.
- Denaturasi ireversibel menyiratkan penghancuran total molekul, bahkan setelah reagen denaturasi dihilangkan dari larutan, aktivitas fisiologis tidak kembali.
Fitur protein terdenaturasi
Setelah denaturasi protein, ia memperoleh sifat-sifat tertentu:
- Dibandingkan dengan molekul protein asli, jumlah gugus fungsional atau reaktif dalam molekul meningkat.
- Kelarutan dan proses pengendapan protein menurun, yang difasilitasi oleh hilangnya membran air. Strukturnya terungkap, radikal hidrofobik muncul, netralisasi muatan fragmen polar diamati.
- Konfigurasi molekul protein berubah.
- Aktivitas biologis hilang, alasannya adalah pelanggaran terhadap struktur asli.

Konsekuensi
Setelah denaturasi, struktur padat asli diubah menjadi bentuk longgar dan tidak terlipat, dan penetrasi enzim yang diperlukan untuk penghancuran ikatan peptida disederhanakan.
Konformasi molekul protein ditentukan oleh terjadinya jumlah ikatan yang cukup antara berbagai bagian rantai polipeptida tertentu.
Protein, yang terdiri dari sejumlah atom yang cukup yang berada dalam gerakan kacau terus menerus, berkontribusi pada pergerakan tertentu dari bagian rantai polipeptida, yang menyebabkan pelanggaran terhadap keseluruhan struktur protein, penurunan fungsi fisiologisnya.
Protein memiliki labilitas konformasi, yaitu kecenderungan terhadap perubahan kecil dalam konformasi yang terjadi sebagai akibat putusnya beberapa ikatan dan pembentukan ikatan lainnya.
Denaturasi protein menyebabkan perubahan sifat kimianya, kemampuan berinteraksi dengan zat lain. Terjadi perubahan struktur spasial dan lokasi yang bersentuhan langsung dengan molekul lain, dan keseluruhan konformasi secara keseluruhan. Perubahan konformasi yang diamati penting untuk berfungsinya protein dalam sel hidup.
Mekanisme kehancuran
Proses denaturasi protein melibatkan penghancuran ikatan kimia (hidrogen, disulfida, elektrostatik) yang menstabilkan tingkat tertinggi organisasi molekul protein. Akibatnya, struktur spasial protein berubah. Dalam banyak situasi, tidak terjadi kerusakan pada struktur utamanya. Hal ini memungkinkan, setelah pelepasan rantai polipeptida, untuk memutar protein secara spontan, menciptakan "kusut acak". Dalam situasi seperti itu, ada transisi ke keadaan tidak teratur, yang memiliki perbedaan signifikan dari konformasi aslinya.

Kesimpulan
Suhu denaturasi protein melebihi 56 derajat Celcius. Tanda-tanda khas dari denaturasi molekul protein yang ireversibel adalah penurunan kelarutan dan hidrofilisitas molekul, peningkatan aktivitas optik, penurunan stabilitas larutan protein, dan peningkatan viskositas.
Denaturasi menyebabkan agregasi partikel, mereka dapat mengendap. Jika suatu protein dipengaruhi oleh zat denaturasi dalam waktu singkat, kemungkinan untuk memulihkan struktur protein aslinya tinggi. Proses ini banyak digunakan dalam pengolahan makanan, pengalengan, pembuatan sepatu, pakaian, dan pengeringan buah-buahan dan sayuran. Denaturasi digunakan dalam kedokteran hewan, kedokteran, klinik, farmasi, ketika melakukan studi biokimia terkait pengendapan protein dalam bahan biologis. Selanjutnya, identifikasi spesimen non-protein dan molekul rendah dalam larutan uji dilakukan, sehingga dimungkinkan untuk menentukan kandungan kuantitatif zat. Saat ini, mereka sedang mencari cara untuk melindungi molekul protein dari kehancuran.
Sifat dan fungsi protein
Struktur dan sifat protein dapat berubah di bawah pengaruh berbagai faktor fisikokimia: aksi asam pekat dan basa, logam berat, perubahan suhu, dll. Beberapa protein dengan mudah mengubah strukturnya di bawah pengaruh berbagai faktor, yang lain resisten terhadap pengaruh seperti itu. Sifat utama suatu protein adalah denaturasi, renaturasi, dan penghancuran.
Denaturasi
Denaturasi - Ini adalah proses mengganggu struktur alami suatu protein dengan tetap mempertahankan ikatan peptida (struktur primer). Mungkin tidak dapat diubah proses. Tetapi jika aksi faktor negatif berhenti pada tahap pertama, protein dapat mengembalikan keadaan normalnya, yaitu terjadi denaturasi terbalik - renaturasi.
Renaturasi
Renaturasi adalah kemampuan protein untuk mengembalikan struktur normalnya setelah aksi faktor negatif dihilangkan. Kinerja beberapa fungsi - motorik, sinyal, katalitik, dll. - pada organisme hidup dikaitkan dengan denaturasi balik parsial protein.
Penghancuran
Penghancuran adalah proses penghancuran struktur primer protein. Itu selalu merupakan proses yang tidak dapat diubah.
Fungsi protein
Protein melakukan fungsi utama berikut:
- Struktural (konstruksi). Mereka adalah bagian dari membran, mikrotubulus dan mikrofilamen yang bertindak sebagai sitoskeleton. Ikatan mengandung protein elastin, rambut, kuku dan bulu mengandung protein keratin, tulang rawan dan tendon mengandung protein kolagen, tulang mengandung protein osein.
- Protektif. Limfosit menghasilkan protein khusus – antibodi yang mampu mengenali dan menetralisir bakteri, virus, protein asing bagi tubuh. Protein fibrin, tromboplastin dan trombin terlibat dalam proses pembekuan darah. Mereka mencegah kehilangan banyak darah. Menanggapi serangan patogen, tanaman juga mensintesis sejumlah protein pertahanan.
- Sinyal. Memberikan penyerapan selektif zat tertentu oleh sel dan membantu melindunginya. Pada saat yang sama, protein kompleks individu pada membran sel mampu mengenali senyawa kimia tertentu dan meresponsnya. Mereka mengikatnya atau mengubah strukturnya dan mengirimkan sinyal tentang zat ini ke bagian lain membran atau jauh ke dalam sel.
- Motorik (kontraktil). Memberikan kemampuan sel untuk bergerak, berubah bentuk. Misalnya, protein kontraktil aktin dan miosin berfungsi di otot rangka dan banyak sel lainnya. Mikrotubulus silia dan flagela sel eukariotik mengandung protein tubulin.
- Peraturan. Mereka adalah hormon yang bersifat protein pada hewan yang mengatur pertumbuhan, pubertas, siklus seksual, perubahan integumen, dll. Beberapa protein mengatur aktivitas metabolisme.
- Mengangkut. Protein mengangkut ion anorganik, gas (oksigen, karbon dioksida), zat organik tertentu. Protein transpor ditemukan di membran sel, di sel darah merah, dll. Ada protein transpor di dalam darah yang mengenali dan mengikat hormon tertentu dan membawanya ke sel tertentu. Misalnya hemocyanin (protein biru) pada invertebrata, hemoglobin pada vertebrata membawa oksigen.
- Menyimpan. Mereka dapat disimpan dalam endosperm benih banyak tanaman (dalam sereal 15-25%, kacang-kacangan - hingga 45%), dalam telur burung, reptil, dll.
- Bergizi. Embrio benih beberapa tanaman mengkonsumsi protein pada tahap pertama perkembangannya, yang disimpan dalam cadangan.
- Energi. Ketika protein dipecah, energi dilepaskan. Asam amino, yang terbentuk selama pemecahan protein, digunakan untuk biosintesis protein yang dibutuhkan tubuh, atau diurai untuk melepaskan energi. Dengan pemecahan lengkap 1 g protein, rata-rata 17,2 kJ energi dilepaskan. Namun protein sebagai sumber energi sangat jarang digunakan, terutama pada saat cadangan karbohidrat dan lemak habis.
- Enzimatik (katalitik). Fungsi ini dilakukan oleh protein – enzim yang mempercepat reaksi biokimia dalam tubuh.
- Fungsi antibeku. Plasma darah beberapa organisme hidup mengandung protein yang mencegahnya membeku pada suhu rendah.
Beberapa organisme yang hidup dalam kondisi panas memiliki protein yang tidak mengalami denaturasi bahkan pada suhu +50…90 °C.
Beberapa protein membentuk kompleks kompleks dengan pigmen, asam nukleat.
Denaturasi- ini merupakan pelanggaran terhadap struktur spasial asli molekul protein di bawah pengaruh pengaruh eksternal.
Pengaruh eksternal tersebut termasuk pemanasan (denaturasi termal); gemetar, mencambuk dan efek mekanis tajam lainnya (denaturasi permukaan); konsentrasi tinggi ion hidrogen atau hidroksida (denaturasi asam atau basa); dehidrasi intensif selama pengeringan dan pembekuan produk, dll.
Untuk proses teknologi produksi produk katering umum, denaturasi termal protein adalah yang paling penting secara praktis. Ketika protein dipanaskan, gerakan termal atom dan rantai polipeptida dalam molekul protein meningkat, akibatnya apa yang disebut ikatan silang lemah antara rantai polipeptida (misalnya, rantai hidrogen) dihancurkan, dan interaksi hidrofobik dan lainnya antara rantai samping juga melemah. Akibatnya, konformasi rantai polipeptida pada molekul protein berubah. Pada protein globular, butiran protein terbuka, diikuti dengan pelipatan menjadi tipe baru; ikatan kuat (kovalen) dari molekul protein (peptida, disulfida) tidak terganggu selama penataan ulang tersebut. Denaturasi termal protein fibrilar kolagen dapat direpresentasikan sebagai pencairan, karena sebagai akibat dari penghancuran sejumlah besar ikatan silang antara rantai polipeptida, struktur fibrilarnya menghilang, dan serat kolagen berubah menjadi massa vitreous yang kontinu.
Dalam penataan ulang molekul protein selama denaturasi, peran aktif dimiliki oleh air, yang terlibat dalam pembentukan struktur konformasi baru dari protein yang terdenaturasi. Protein dehidrasi sempurna yang diisolasi dalam bentuk kristal sangat stabil dan tidak mengalami denaturasi meskipun dipanaskan dalam waktu lama hingga suhu 100 °C ke atas. Efek denaturasi pengaruh luar semakin kuat, semakin tinggi hidrasi protein dan semakin rendah konsentrasinya dalam larutan.
Denaturasi disertai dengan perubahan sifat terpenting protein: hilangnya aktivitas biologis, spesifisitas spesies, kemampuan terhidrasi (larut, membengkak); peningkatan serangan enzim proteolitik (termasuk enzim pencernaan); meningkatkan reaktivitas protein; agregasi molekul protein.
Hilangnya aktivitas biologis protein akibat denaturasi termal menyebabkan inaktivasi enzim yang terkandung dalam sel tumbuhan dan hewan, serta kematian mikroorganisme yang masuk ke dalam produk selama produksi, transportasi, dan penyimpanannya. Secara umum proses ini dinilai positif, karena produk jadi, tanpa adanya kontaminasi ulang oleh mikroorganisme, dapat disimpan dalam waktu yang relatif lama (dalam bentuk dingin atau beku).
Akibat hilangnya kekhususan spesies oleh protein, nilai gizi produk tidak berkurang. Dalam beberapa kasus, sifat protein ini digunakan untuk mengontrol proses teknologi. Misalnya, dengan mengubah warna kromoprotein daging - mioglobin dari merah menjadi coklat muda, kesiapan kuliner sebagian besar hidangan daging dapat dinilai.
Hilangnya kemampuan protein untuk terhidrasi dijelaskan oleh fakta bahwa ketika konformasi rantai polipeptida berubah, gugus hidrofobik muncul pada permukaan molekul protein, dan gugus hidrofilik tersumbat akibat pembentukan ikatan intramolekul.
Peningkatan hidrolisis protein terdenaturasi oleh enzim proteolitik, peningkatan sensitivitasnya terhadap banyak reagen kimia dijelaskan oleh fakta bahwa pada protein asli, gugus peptida dan banyak gugus fungsional (reaktif) dilindungi oleh cangkang hidrasi eksternal atau terletak di dalam protein. globule dan dengan demikian terlindungi dari pengaruh eksternal.
Selama denaturasi, gugus-gugus ini muncul di permukaan molekul protein.
Pengumpulan - ini adalah interaksi molekul protein yang terdenaturasi, akibatnya terbentuk ikatan antarmolekul, baik yang kuat, misalnya disulfida, maupun banyak ikatan lemah.
Akibat agregasi molekul protein adalah terbentuknya partikel yang lebih besar. Konsekuensi dari agregasi lebih lanjut partikel protein berbeda-beda bergantung pada konsentrasi protein dalam larutan. Dalam larutan dengan konsentrasi rendah, serpihan protein terbentuk, yang mengendap atau mengapung ke permukaan cairan (seringkali membentuk busa). Contoh agregasi jenis ini adalah pengendapan serpihan laktoalbumin yang terdenaturasi (saat susu direbus), pembentukan serpihan dan busa protein pada permukaan kaldu daging dan ikan. Konsentrasi protein dalam larutan ini tidak melebihi 1%.
Ketika protein didenaturasi dalam larutan protein yang lebih pekat, sebagai hasil agregasinya, terbentuklah jeli kontinu yang menahan semua air yang terkandung dalam sistem. Jenis agregasi protein ini diamati selama perlakuan panas pada daging, ikan, telur dan berbagai campuran berdasarkan bahan tersebut. Konsentrasi protein optimal dimana larutan protein membentuk jeli padat dalam kondisi pemanasan tidak diketahui. Mengingat kemampuan protein untuk membentuk gel bergantung pada konfigurasi (asimetri) molekul, maka harus diasumsikan bahwa batas konsentrasi yang ditentukan berbeda untuk protein yang berbeda.
Protein dalam keadaan jeli yang kurang lebih encer dipadatkan selama denaturasi termal, yaitu. dehidrasi mereka terjadi dengan pemisahan cairan ke lingkungan. Jeli yang dipanaskan biasanya memiliki volume, massa, plastisitas yang lebih rendah, serta peningkatan kekuatan mekanik dan elastisitas yang lebih besar dibandingkan dengan jeli asli yang terbuat dari protein asli. Perubahan ini juga merupakan konsekuensi dari agregasi molekul protein yang terdenaturasi. Karakteristik reologi jeli yang dipadatkan bergantung pada suhu, pH medium, dan lama pemanasan.
Denaturasi protein dalam jeli, disertai pemadatan dan pemisahan air, terjadi selama perlakuan panas pada daging, ikan, pemasakan kacang-kacangan, dan produk adonan kue.
Setiap protein mempunyai suhu denaturasi tertentu. Dalam produk makanan dan produk setengah jadi, tingkat suhu terendah biasanya dicatat, di mana perubahan denaturasi yang terlihat pada protein yang paling labil dimulai. Misalnya, untuk protein ikan, suhunya sekitar 30 C, putih telur - 55 C.
Pada nilai pH yang mendekati titik isoelektrik protein, denaturasi terjadi pada suhu yang lebih rendah dan disertai dengan dehidrasi maksimum protein. Pergeseran pH medium ke satu arah atau lainnya dari titik isoelektrik protein berkontribusi pada peningkatan stabilitas termalnya. Jadi, globulin X yang diisolasi dari jaringan otot ikan, yang memiliki titik isoelektrik pada pH 6,0, mengalami denaturasi pada suhu 50 °C dalam media sedikit asam (pH 6,5), dan pada suhu 80 °C dalam media netral (pH 7,0).
Reaksi lingkungan juga mempengaruhi derajat dehidrasi protein dalam jeli selama perlakuan panas terhadap produk. Perubahan terarah dalam reaksi lingkungan banyak digunakan dalam teknologi untuk meningkatkan kualitas masakan. Jadi, saat merebus unggas, ikan, merebus daging, mengasinkan daging dan ikan, asam, anggur atau bumbu asam lainnya ditambahkan sebelum digoreng untuk menciptakan lingkungan asam dengan nilai pH yang jauh lebih rendah daripada titik isoelektrik protein produk. Dalam kondisi ini, dehidrasi protein dalam jeli berkurang dan produk jadi menjadi lebih berair.
Dalam lingkungan asam, kolagen daging dan ikan membengkak, suhu denaturasinya menurun, transisi ke glutin dipercepat, sehingga produk jadi lebih empuk.
Suhu denaturasi protein meningkat dengan adanya protein lain yang lebih termostabil dan beberapa zat yang bersifat non-protein, seperti sukrosa. Sifat protein ini digunakan ketika, selama perlakuan panas, diperlukan peningkatan suhu campuran (misalnya, untuk tujuan pasteurisasi), mencegah denaturasi protein. Denaturasi termal beberapa protein dapat terjadi tanpa perubahan yang terlihat pada larutan protein, seperti yang diamati, misalnya, pada kasein susu.
Makanan yang dimasak mungkin mengandung lebih banyak atau lebih sedikit protein asli yang tidak didenaturasi, termasuk beberapa enzim.
Sifat paling penting dari protein adalah kemampuannya untuk menunjukkan sifat asam dan basa, yaitu bertindak sebagai elektrolit amfoter. Protein terlibat aktif dalam reaksi kimia. Sifat ini disebabkan oleh fakta bahwa asam amino penyusun protein mengandung gugus fungsi berbeda yang dapat bereaksi dengan zat lain. Protein memiliki afinitas yang tinggi terhadap air, yaitu bersifat hidrofilik. kelarutan yang berbeda dalam air. Protein larut membentuk larutan koloid. Hidrolisis - di bawah pengaruh larutan asam mineral atau enzim, struktur utama protein dihancurkan dan campuran asam amino terbentuk.
Denaturasi adalah hilangnya organisasi struktural molekul protein (sekunder, tersier, kuaterner). Hal ini dapat disebabkan oleh perubahan suhu, dehidrasi, penyinaran, perubahan pH lingkungan, dll. Denaturasi bersifat reversibel atau ireversibel. Denaturasi reversibel tidak mempengaruhi struktur primer. Denaturasi ireversibel menghancurkan struktur primer. Jika perubahan kondisi lingkungan tidak menyebabkan kerusakan struktur utama molekul, maka ketika kondisi lingkungan normal dipulihkan, struktur protein dibuat ulang sepenuhnya - renaturasi.
Fungsi protein dalam sel.
Salah satu fungsi terpenting protein dalam sel adalah konstruksi : protein terlibat dalam pembentukan semua membran sel di organel sel, serta struktur ekstraseluler. Yang paling penting adalah Ke atalitik fungsi protein. Semua katalis biologis - enzim - zat yang bersifat protein. Mereka mempercepat reaksi kimia yang terjadi di dalam sel hingga puluhan dan ratusan ribu kali lipat. Enzim hanya mengkatalisis satu reaksi, yaitu. dia berpikiran sempit. Spesifisitas yang tinggi dari reaksi enzimatik disebabkan oleh fakta bahwa konfigurasi spasial dari situs aktif enzim, yaitu. daerah protein yang mengikat suatu molekul sama persis dengan konfigurasi molekul tersebut. Motor fungsi tubuh disediakan oleh protein kontraktil. Protein-protein ini terlibat dalam semua jenis pergerakan yang mampu dilakukan sel dan organisme: kerlipan silia dan pemukulan flagela pada protozoa, kontraksi otot pada hewan. Mengangkut fungsi protein adalah untuk mengikat unsur-unsur kimia (misalnya oksigen) atau zat aktif biologis (hormon) dan memindahkannya ke berbagai jaringan dan organ tubuh. Ketika protein atau mikroorganisme asing masuk ke dalam tubuh, sel darah putih - leukosit - membentuk protein khusus - antibodi. Mereka mengikat dan menetralkan zat-zat yang tidak biasa bagi tubuh. Ini mengungkapkan protektif fungsi protein. Protein juga berfungsi sebagai salah satu sumber energi dalam sel, yaitu berfungsi energi fungsi. Dengan pemecahan lengkap 1 g protein, 17,6 kJ energi dilepaskan.
Enzim. Sifat dasar proses enzimatik.
Enzim , atau enzim - biasanya molekul protein atau molekul RNA (ribozim) atau kompleksnya yang mempercepat (mengkatalisis) reaksi kimia dalam sistem kehidupan, protein spesifik yang meningkatkan laju reaksi kimia dalam sel semua organisme hidup Semua reaksi yang melibatkan enzim berlangsung terutama , dalam media netral, sedikit basa atau sedikit asam. Namun, aktivitas maksimum masing-masing enzim muncul pada nilai pH yang ditentukan secara ketat. Untuk kerja sebagian besar enzim pada hewan berdarah panas, suhu yang paling disukai adalah 37-40C. Tanaman pada suhu di bawah 0C. Kerja enzim tidak berhenti sepenuhnya, meskipun aktivitas vital tanaman menurun tajam. Proses enzimatik, pada umumnya, tidak dapat berlangsung pada suhu di atas 70C, karena enzim, seperti semua protein, mengalami denaturasi termal (penghancuran struktural).
Struktur enzim.
Dalam komposisi enzim, daerah dibedakan yang melakukan berbagai fungsi:
1. Pusat aktif - kumpulan residu asam amino (biasanya 12-16), yang memberikan ikatan langsung ke molekul substrat(Substrat (S) adalah zat yang transformasi kimianya menjadi produk (P) dikatalisis oleh enzim (E)) dan dikatalisis. Radikal asam amino di pusat aktif dapat berada dalam kombinasi apa pun, sedangkan asam amino terletak bersebelahan, yang berjauhan secara signifikan satu sama lain dalam rantai linier. Enzim yang mempunyai beberapa monomer dalam komposisinya mungkin mempunyai beberapa pusat aktif sesuai dengan jumlah subunitnya. Juga, dua atau lebih subunit dapat membentuk satu situs aktif.
Pada gilirannya, dua bagian dibedakan di pusat aktif:
jangkar (kontak, pengikatan, pusat adsorpsi) - bertanggung jawab atas pengikatan dan orientasi substrat di pusat aktif,
katalitik - bertanggung jawab langsung atas pelaksanaan reaksi.
2. Pusat alosterik (allos - alien) - pusat pengaturan aktivitas enzim, yang terpisah secara spasial dari pusat aktif dan tidak terdapat pada semua enzim. Pengikatan ke pusat alosterik suatu molekul (disebut aktivator atau inhibitor, serta efektor, modulator, regulator) menyebabkan perubahan konfigurasi protein enzim dan, sebagai akibatnya, laju reaksi enzimatik. Produk dari reaksi ini atau salah satu reaksi selanjutnya, substrat reaksi, atau zat lain dapat bertindak sebagai pengatur tersebut. Enzim alosterik adalah protein polimer, pusat aktif dan pengaturannya terletak di subunit yang berbeda.
Denaturasi adalah proses kompleks di mana, di bawah pengaruh faktor eksternal (suhu, aksi mekanis, aksi asam, basa, ultrasound, dll.), terjadi perubahan pada struktur makromolekul protein sekunder, tersier, dan kuaterner, yaitu. struktur spasial asli (alami). Struktur primer dan akibatnya komposisi kimia protein tidak berubah.
Selama pemasakan, denaturasi protein paling sering disebabkan oleh pemanasan. Proses pada protein globular dan fibrilar ini terjadi secara berbeda.
Dalam protein globular, ketika dipanaskan, pergerakan termal rantai polipeptida di dalam globula meningkat; ikatan hidrogen yang menahannya pada posisi tertentu putus dan rantai polipeptida terbuka dan kemudian terlipat dengan cara yang baru. Dalam hal ini, gugus hidrofilik polar (bermuatan) yang terletak di permukaan globul dan memberikan muatan serta stabilitasnya bergerak di dalam globul, dan gugus hidrofobik reaktif (disulfida, sulfhidril, dll.), yang tidak mampu menahan air, muncul ke permukaannya.
Denaturasi disertai dengan perubahan sifat terpenting protein:
hilangnya sifat individu (misalnya, perubahan warna daging saat dipanaskan karena denaturasi mioglobin);
hilangnya aktivitas biologis (misalnya, kentang, jamur, apel, dan sejumlah produk tanaman lainnya mengandung enzim yang menyebabkan warnanya menjadi gelap; ketika didenaturasi, protein enzim kehilangan aktivitasnya);
peningkatan serangan enzim pencernaan (sebagai aturan, makanan yang diberi perlakuan panas yang mengandung protein dicerna lebih sempurna dan lebih mudah);
hilangnya kemampuan untuk hidrasi (pembubaran, pembengkakan);
hilangnya stabilitas butiran protein, yang disertai dengan agregasinya (pelipatan, atau koagulasi protein).
Agregasi adalah interaksi molekul protein yang terdenaturasi, yang disertai dengan pembentukan partikel yang lebih besar. Secara lahiriah, hal ini dinyatakan berbeda tergantung pada konsentrasi dan keadaan koloid protein dalam larutan. Jadi, dalam larutan konsentrasi rendah (hingga 1%), protein yang terkoagulasi membentuk serpihan (busa di permukaan kaldu). Dalam larutan protein yang lebih pekat (misalnya putih telur), denaturasi membentuk gel kontinu yang menahan semua air yang terkandung dalam sistem koloid.
Protein, yang merupakan gel yang kurang lebih encer (protein otot daging, unggas, ikan; protein sereal, kacang-kacangan, tepung setelah hidrasi, dll.), dipadatkan selama denaturasi, sedangkan dehidrasinya terjadi dengan pemisahan cairan ke lingkungan. . Gel protein yang dipanaskan biasanya memiliki volume, massa, kekuatan mekanik dan elastisitas yang lebih kecil dibandingkan dengan gel asli yang terbuat dari protein asli (alami). Laju agregasi sol protein bergantung pada pH medium. Protein kurang stabil di dekat titik isoelektrik.
Untuk meningkatkan kualitas masakan dan produk kuliner, perubahan terarah pada reaksi lingkungan banyak digunakan. Jadi, saat mengasinkan daging, unggas, ikan sebelum digoreng; menambahkan asam sitrat atau anggur putih kering saat merebus ikan, ayam; penggunaan pure tomat saat merebus daging, dll. menciptakan lingkungan asam dengan nilai pH jauh di bawah titik isoelektrik protein produk. Karena lebih sedikit dehidrasi protein, produk menjadi lebih berair.
Protein fibrilar mengalami denaturasi secara berbeda: ikatan yang menahan heliks rantai polipeptidanya putus, dan fibril (benang) protein memendek panjangnya. Ini adalah bagaimana protein jaringan ikat daging dan ikan mengalami denaturasi. literatur
Ada 2 jenis denaturasi:
Denaturasi reversibel - renaturasi atau reaktivasi - adalah proses di mana protein yang terdenaturasi, setelah menghilangkan zat yang terdenaturasi, mengatur kembali dirinya ke dalam struktur aslinya dengan pemulihan aktivitas biologis.
Denaturasi ireversibel adalah suatu proses di mana aktivitas biologis tidak pulih setelah penghilangan agen denaturasi.
Jadi, faktor fisik menyebabkan denaturasi: suhu, tekanan, pengaruh mekanis, radiasi ultrasonik dan pengion; faktor kimia: asam, basa, pelarut organik, alkaloid, garam logam berat.
Mencambuk putih telur, krim mengubahnya menjadi busa yang terdiri dari gelembung udara yang dikelilingi oleh lapisan protein tipis, yang pembentukannya disertai dengan penyebaran rantai polipeptida sebagai akibat dari putusnya ikatan selama aksi mekanis. Jadi, selama pembentukan film, terjadi denaturasi protein sebagian atau seluruhnya. Jenis denaturasi ini disebut denaturasi protein permukaan.
Untuk proses kuliner, denaturasi termal protein sangat penting. Mekanisme denaturasi termal protein dapat dilihat dengan menggunakan contoh protein globular. Molekul protein globular utama terdiri dari satu atau lebih rantai polipeptida, terlipat dan membentuk gulungan. Struktur seperti itu distabilkan oleh ikatan lemah, di antaranya ikatan hidrogen memainkan peran penting, membentuk jembatan melintang antara rantai peptida paralel atau lipatannya.
Ketika protein dipanaskan, peningkatan pergerakan rantai atau lipatan polipeptida dimulai, yang menyebabkan putusnya ikatan rapuh di antara keduanya. Protein terbuka dan memperoleh bentuk yang tidak biasa dan tidak alami, hidrogen dan ikatan lainnya terbentuk di tempat yang tidak biasa untuk molekul ini, dan konfigurasi molekul berubah. Akibatnya, lipatan terbuka dan tersusun ulang, disertai dengan redistribusi gugus polar dan nonpolar, dan radikal nonpolar terkonsentrasi pada permukaan butiran, sehingga mengurangi hidrofilisitasnya. Selama denaturasi, protein menjadi tidak larut dan, pada tingkat yang lebih besar atau lebih kecil, kehilangan kemampuannya untuk membengkak.
Dengan perlakuan panas yang berkepanjangan, protein mengalami perubahan yang lebih dalam terkait dengan penghancuran makromolekulnya. Pada perubahan tahap pertama, gugus fungsi dapat dipisahkan dari molekul protein dengan pembentukan senyawa yang mudah menguap seperti amonia, hidrogen sulfida, hidrogen fosfida, karbon dioksida, dll. Dengan terakumulasi dalam produk, mereka berpartisipasi dalam pembentukan rasa. dan aroma produk jadi. Selama perlakuan hidrotermal lebih lanjut, protein dihidrolisis, sedangkan ikatan primer (peptida) diputus dengan pembentukan zat nitrogen terlarut yang bersifat non-protein (misalnya, transisi kolagen menjadi glutin). Penghancuran protein dapat menjadi pengobatan kuliner yang bertujuan untuk mengintensifkan proses teknologi.